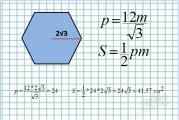
Editorii caută autori de literatură educațională. Editori de literatură educațională. „Tehnologii subțiri intensive în știință”
Sisteme disperse
Sistemele dispersate au fost studiate de F. Selmi, M. Faraday, T. Graham, I.G. Borshchev, Vo. Ostwald, G. Freindlikh, A.V. Dumansky, N.P. Peskov și alții.
1. Tipuri de sisteme dispersate: Soluri T/L, suspensii T/L, aerosoli T/G sau L/G (T sau L/G), emulsii L/L, spume G/L, pulberi T/G. Diferența dintre suspensii și soluri este dimensiunea a fazei dispersate. Pulberile diferă de aerosoli într-o concentrație mult mai mare de particule solide.
2. Clasificarea sistemelor disperse:
I) de către starea de agregare fază dispersată și mediu de dispersie, sunt cunoscute 8 sisteme.
tabelul 1
| Faza dispersată | Mediu de dispersie | Simbol | Tipul sistemelor dispersate | Exemple |
| Solid | Lichid solid | T/T T/F T/Y | Minerale, aliaje Suspensii, soluri Aerosoli, pulberi | Rubin, diamant, oțel Suspensii, argilă, vopsele cu pigmenți solizi, paste, soluții metalice în apă, medicamente. Praf, fum, pulberi, inclusiv ca medicamente. |
| Lichid | Lichid solid | W/T W/W W/G | Corpi porosi Emulsii Aerosoli | Perle, opal, lichid în corpuri poroase, adsorbanți (în lichide), soluri Creme, lapte, maioneză, ulei natural Ceață, nori, droguri. |
| gazos | Lichid solid | G/T G/W | Corpuri poroase Spuma | Spume dure, piatră ponce, pâine, adsorbanți (în gaze). Frisca; spume: sapunoase, antiincendiare, fluorurate; medicamente. |
Potrivit lui Zsigmondy: solidozoli– sisteme cu mediu de dispersie solid; liosolurile(soluri) - cu un mediu de dispersie lichid; aerosoli– cu un mediu de dispersie gazos.
II) după gradul de dispersie(în funcție de dimensiunea particulelor fazei dispersate). Acestea sunt sisteme eterogene, instabile.
a) grosier cu o dimensiune a particulelor mai mare de 10 -7 m - suspensii, emulsii, pulberi, spume; Acestea sunt sisteme eterogene, instabile.
b) sisteme coloidale cu dimensiunea particulelor de 10 -7 - 10 -9 m - sol; acestea sunt sisteme ultramicroeterogene (eterogenitatea se detectează doar cu ajutorul unui ultramicroscop) și sunt destul de stabile.
În această secțiune, în mod tradițional, pentru comparație, sunt luate în considerare soluțiile adevărate:
ü sisteme dispersate molecular având particule de ordinul a 10 -10 m. Acestea sunt, de regulă, soluții de neelectroliți (alcool, glucoză, uree) și electroliți slabi (acid acetic);
ü sisteme dispersate de ioni cu particule mai mici de 10 -10 m, acestea sunt soluții electrolitice (soluție de clorură de sodiu.
Soluțiile sunt sisteme omogene, sunt stabile.
III) privind interacțiunea interfacială.În funcție de intensitatea interacțiunii dintre faza dispersată și mediul de dispersie, se disting sistemele:
- liofil– interacțiune puternică între faza dispersată și mediul de dispersie (faza dispersată este bine umezită, se umflă sau se dizolvă). Un exemplu de sisteme liofile sunt soluțiile de săpunuri (săruri de sodiu și potasiu ale acizilor carboxilici superiori), alcaloizi (baze organice de origine naturală care conțin azot), taninuri (sau taninuri - compuși fenolici de origine vegetală care conțin un numar mare de grupele –OH), unii coloranți. Se formează spontan și sunt reversibile. Stabil termodinamic.
- liofob- interacțiune slabă a fazei dispersate și a mediului de dispersie (particulele dispersate sunt slab umezite, nu se umflă și nu se dizolvă.). Liofob - coloizi ai substanțelor slab solubile: metale, hidroxid de fier (III), în sistemele biologice - săruri insolubile de calciu, magneziu, colesterol. Solurile liofobe pot exista perioadă lungă de timp numai în prezența stabilizatorilor și sunt ireversibile. instabil termodinamic.
Dacă sistemul de dispersie este apă, atunci sistemele corespunzătoare se numesc hidrofile sau hidrofobe.
IV) dupa structura: legat-dispersat, liber-dispersat Fig.1.
Liber dispersat- particulele fazei dispersate nu sunt interconectate - suspensii, emulsii, soluri, aerosoli, paste medicinale (pasta de zinc).
Liant dispersat– particulele fazei dispersate formează o rețea spațială, iar faza nu se poate mișca liber – geluri (stare „jelly-like”, obținute din soluri) și jeleuri (DIU), spume, membrane biologice, soluții solide (aliaje), corpuri poroase.
Împărțirea este condiționată. Procesele de formare a structurii care au loc în sistemele liber-disperse se pot sfârși cu formarea de sisteme legate-disperse. Solul se transformă într-un gel. Si invers. Observat tixotropie– modificarea reversibilă a proprietăților fizice și mecanice ale sistemului.
| | |||||
| coloid solid | ↔ gel | ↔ sol | |||
| sistem de dispersie legat | sistem liber dispersat |
3. Metode de obţinere a sistemelor coloidale(Ghid metodologic al atelierului de chimie generală, pp. 161-163).
A. Prepararea suspensiilor.
Suspensiile, ca și orice alt sistem dispersat, pot fi obținute prin două grupe de metode: din partea sistemelor dispersate grosier, prin metode de dispersie, din partea soluțiilor adevărate, prin metode de condensare.
Întrucât suspensiile sunt suspensii de pulberi într-un lichid, cea mai simplă și utilizată metodă de obținere a suspensiilor diluate atât în industrie, cât și în viața de zi cu zi este agitarea pulberii corespunzătoare într-un lichid adecvat folosind diverse dispozitive de amestecare (mixere, mixere etc.) . ). Pentru a obține suspensii concentrate (paste), pulberile corespunzătoare sunt triturate cu o cantitate mică de lichid.
Suspensiile se formează și ca urmare a coagulării liosolurilor. Prin urmare, metodele de implementare a coagulării sunt în același timp metode de obținere a suspensiilor.
B. Obținerea emulsiilor.
Un sistem de două lichide nemiscibile va fi într-o stare termodinamică stabilă dacă este format din două straturi continue: superior (lichid mai ușor) și inferior (lichid mai greu). De îndată ce începem să spargem unul dintre straturile continue în picături pentru a obține o emulsie, suprafața interfațală va crește și, în consecință, energia de suprafață liberă și sistemul va deveni termodinamic instabil. Cu cât se va cheltui mai multă energie pentru formarea emulsiei, cu atât aceasta va fi mai instabilă. Pentru a trăda emulsia relativ rezistență, utilizați substanțe speciale - stabilizatori, numite emulgatori. Aceștia sunt agenți tensioactivi sau DIU care sunt absorbiți la interfață și reduc energia Gibbs de suprafață (tensiunea interfacială); ca urmare, se formează o peliculă de absorbție puternică din punct de vedere mecanic. Aproape toate emulsiile (cu excepția unora care se formează spontan) se obțin numai în prezența emulgatorilor.
Emulsiile sunt sisteme cu cel puțin trei componente care constau dintr-un lichid polar, un lichid nepolar și un emulgator. În acest caz, unul dintre lichide este sub formă de picături. Picăturile de dimensiunea necesară pot fi obținute în două moduri diferite: metoda de condensare, creșterea lor din centre mici de formare a picăturilor și metoda de dispersie, zdrobirea picăturilor mari.
Metodele de dispersie sunt cele mai comune atât în laborator, cât și în practica industrială.
Metode de purificare a sistemelor coloidale.
Pentru mai multe informații, consultați Ghidul metodologic (pag. 163.)
a) Filtrare (lat. filtrum - pâslă),
b) Dializa (greaca dializa - separare). Dializa compensatorie. Electrodializa.
c) Ultrafiltrare (lat. ultra - over).
d) Osmoza inversa.
5. Formarea, structura și încărcarea unei particule coloidale. formula micelară. Structura stratului dublu electric. potenţialul electrocinetic.
Vezi și ghid metodologic (p. 164-165.)
Adesea, pe lângă micelii, un stabilizator și un solvent, sistemele dispersate rezultate conțin substanțe cu greutate moleculară mică (impurități). Ele reduc stabilitatea DS (pot neutraliza încărcarea particulelor coloidale, ceea ce duce la coagularea și distrugerea sistemelor coloidale). Pentru a purifica sistemele coloidale de impurități cu greutate moleculară mică, se utilizează dializa, electrodializa și ultrafiltrarea.
Dializă(propus și denumit de T. Graham) se bazează pe trecerea unei soluții coloidale printr-o membrană semipermeabilă. Cel mai simplu dializator (Fig. 5) este o pungă dintr-un material semipermeabil, în care se toarnă o soluție coloidală, iar punga se coboară într-un vas cu apă (solvent). Datorită dimensiunii mici a găurilor, membranele semi-permeabile rețin particulele coloidale, în timp ce cele cu molecule scăzute trec prin membrană în solvent. Ca rezultat, substanțele cu greutate moleculară mică sunt îndepărtate din soluția coloidală. Anterior, pereții vezicii urinare sau ai vezicii biliare, intestinele și pergamentul erau utilizați ca membrană semipermeabilă. În prezent, membranele din colodion (o soluție de nitrat de celuloză) sunt celofan. Sunt foarte convenabile, pentru că. membranele pot fi realizate cu orice dimensiune a orificiilor.

Orez. 5. Dializatoare T. Graham.
Trebuie remarcat faptul că dializa pe termen lung, pe lângă îndepărtarea impurităților din soluție, poate duce la coagularea sistemului ca urmare a îndepărtării stabilizatorului.
Electrodializa. Deoarece impuritățile cu greutate moleculară mică din sol sunt electroliți, dializa poate fi accelerată prin aplicarea unui curent electric. Pentru a face acest lucru, o soluție coloidală este plasată între două membrane, în afara cărora
Dializa este folosită în biotehnologie și farmaceutică pentru a purifica proteinele, steriletele din impuritățile de sare, pentru a obține medicamente valoroase - globulină, floculante etc. Dializa este utilizată în clinică ca metodă de tratament („hemodializa”) pentru pacienții cu boli ale ficatului , rinichi, sindrom de presiune pe termen lung, în intoxicații acute. În acest caz, sângele pacientului este trecut prin aparatul „rinichi artificial”. Este un sistem cu o membrană, a cărui parte este spălată cu o soluție salină (fiziologică) având aceeași compoziție ca și plasma sanguină, iar cealaltă cu sângele pacientului. În timpul hemodializei, produsele metabolice cu greutate moleculară mică părăsesc sângele prin membrană, în timp ce proteinele rămân în sânge (datorită dimensiunii lor mari). Se păstrează și sărurile necesare organismului, deoarece. nu există un gradient de concentrație între sânge și soluție salină.
|
Ultrafiltrare este dializa efectuată sub presiune sau vid. În esență, nu este o metodă de purificare, ci o metodă de concentrare a DF, adică. separarea DF de mediul de dispersie. Pentru a face acest lucru, soluția coloidală este trecută prin ultrafiltre - filtre mecanice puternice și groase, cu deschideri foarte mici. Ca ultrafiltre se folosesc plăci cu orificii din azbest, porțelan și alte materiale ceramice, acoperite cu celofan, hârtie de filtru impregnată cu coloid. Pentru a accelera filtrarea, aerul este pompat din vas sub filtru sau aerul este suflat deasupra filtrului. În timpul ultrafiltrării, împreună cu impuritățile cu molecularitate scăzută, prin filtre trec și molecule de solvent (mediu de dispersie). Prin urmare, dacă este necesar, după ultrafiltrare, este necesar să se dilueze soluția coloidală la concentrația necesară (inițială). |
Orez. 7. Schema ultrafiltru: A - soluție coloidală; M - membrană; P - placa cu gauri; U - ultrafiltrat |
Ultrafiltrarea este utilizată în același mod ca dializa și electrodializa, în special, pentru a purifica fluidul de cultură din corpurile bacteriilor care produc antibiotice, separă proteinele și le sterilizează soluțiile. În acest caz, bacteriile, virușii rămân pe filtru, iar substanțele medicinale necesare (seruri, vaccinuri) sunt izolate din filtrat.
Cursul numărul 5. Teorii ale stratului dublu electric
Purificarea sistemelor coloidale
În plus față de micelii, un electrolit stabilizator și un solvent, solurile obținute printr-o metodă sau alta conțin impurități cu un nivel molecular scăzut. De exemplu, solul AgNO3, obținut ca urmare a interacțiunii AgNO3 și KJ, conține întotdeauna o cantitate semnificativă de electrolit indiferent KNO3. Impuritățile pot pătrunde în sistemele coloidale din cauza contaminării materiilor prime sau din alte motive.
Electroliții străini reduc stabilitatea solului rezultat și trebuie purificați. Impuritățile cu greutate moleculară mică pot fi îndepărtate din liosoluri folosind dializă, electrodializă și ultrafiltrare.
Dializă se bazează pe capacitatea moleculelor sau ionilor mici de a trece prin pelicule semipermeabile (membrane). Particulele mari de sol nu pot trece prin membrane. Cel mai simplu dializator este o pungă dintr-un material semipermeabil în care se toarnă solul de purificat. Punga este coborâtă într-un vas cu apă.
Astăzi, există multe modele îmbunătățite de dializatoare care asigură un proces de dializă mai rapid. Intensificarea procesului se realizeaza prin cresterea suprafetei prin care are loc dializa, reducerea stratului de lichid dializabil, schimbarea frecventa sau continua a fluidului extern (ex. apa) si incalzire.
Natura membranei, bazată pe sistemul care este dializat, trebuie să fie diferită. Anterior, vezica bovină sau pergamentul era folosit ca membrane. Astăzi, se folosesc adesea membranele preparate dintr-o soluție de nitrat de celuloză. Οʜᴎ sunt convenabile, deoarece pot fi realizate cu pori de orice diametru.
Dializa prelungită determină nu numai îndepărtarea impurităților din soluție, ci și retragerea stabilizatorului, ceea ce poate duce la coagulare.
Electrodializa. În cazurile în care impuritățile sunt electroliți, dializa poate fi accelerată prin aplicarea unui câmp electric. Schema unui electrodializator simplu constă din trei camere separate una de cealaltă prin partiții semipermeabile. Electrozii sunt instalați în camerele laterale, iar apă distilată este furnizată și descărcată continuu în ele, care este lichidul extern al camerei din mijloc, în care este furnizat solul de purificat. Electrodializa este eficientă în special după pretratarea prin dializă convențională, când viteza de difuzie datorată scăderii gradientului de concentrație a electroliților dintre sol și apă este mică și se poate aplica un câmp electric de înaltă tensiune fără teama de încălzire puternică a solului.
Ultrafiltrare. Aceasta este dializa sub presiune. Ultrafiltrarea nu este în esență o metodă de curățare a solurilor, ci o metodă de concentrare a acestora, iar concentrația doar a fazei dispersate crește, în timp ce compoziția mediului de dispersie rămâne practic constantă.
Dacă, după ultrafiltrare parțială, solul este diluat cu un solvent pur până la conținutul anterior al mediului de dispersie, acesta va conține mai puține substanțe cu greutate moleculară mică, dar și mai puțini electroliți stabilizatori.
Folosind ultrafiltre de diferite porozități, este posibil să se separe sistemul coloidal în fracții mai monodisperse și să se determine dispersitatea acestor fracții.
Există multe dispozitive pentru ultrafiltrare. Deoarece ultrafiltrarea se efectuează sub presiune, membrana este fie suprapusă pe o placă cu găuri mai mici care servește drept suport pentru aceasta, fie obținută direct pe pereții unui vas nesmalț.
Purificarea sistemelor coloidale - concept și tipuri. Clasificarea și caracteristicile categoriei „Purificarea sistemelor coloidale” 2017, 2018.
Deoarece sistemele coloidale ocupă o poziție intermediară între sistemele dispersate grosier și soluțiile adevărate în ceea ce privește dimensiunea particulelor, metodele de preparare a acestora pot fi împărțite în două grupe: dispersive și de condensare.
Metode de dispersie bazată pe măcinarea fazei dispersate. Dispersia cu formarea sistemelor coloidale liofile are loc spontan din cauza mișcării termice. Formarea sistemelor coloidale liofobe necesită energie. Pentru a obține gradul necesar de dispersie, aplicați:
zdrobire mecanică cu mori cu bile sau coloidale;
măcinare cu ultrasunete;
dispersie electrică (pentru obținerea solurilor metalice);
dispersie chimică (peptizare).
Dispersia este efectuată în general în prezența unui stabilizator. Acesta poate fi un exces de unul dintre reactivi, surfactanți, proteine, polizaharide.
Metode de condensare constau în interacțiunea moleculelor de soluție adevărată cu formarea de particule de dimensiuni coloidale, care poate fi realizată atât prin metode fizice, cât și chimice.
Metoda fizică este o metodă de înlocuire a solventului (de exemplu, se adaugă apă într-o soluție adevărată de colofoniu în alcool, apoi alcoolul este îndepărtat).
Condensarea chimică constă în obținerea de soluții coloidale prin reacții chimice cu formarea de compuși puțin solubili:
AgNO 3 + KI \u003d AgI (t) + KNO 3
2HAuCl 4 + 3H 2 O \u003d 2Au (t) + 8HCl + 3O 2
Soluțiile stoc trebuie diluate și să conțină un exces de unul dintre reactivi.
3. Metode de purificare a soluţiilor coloidale
Dacă soluțiile coloidale conțin impurități de substanțe dizolvate cu greutate moleculară mică și particule grosiere, atunci prezența lor poate afecta negativ proprietățile solurilor, reducându-le stabilitatea.
Pentru a purifica soluțiile coloidale de impurități, filtrare, dializa, electrodializa, ultrafiltrare.
Filtrare se bazează pe capacitatea particulelor coloidale de a trece prin porii filtrelor convenționale. În acest caz, particulele mai mari sunt reținute. Filtrarea este utilizată pentru a purifica soluțiile coloidale din impuritățile particulelor grosiere.
Dializă- îndepărtarea cu ajutorul membranelor a compuşilor cu molecul scăzut din soluţiile coloidale şi soluţiile DIU. În acest caz, proprietatea membranelor este folosită pentru a trece molecule și ioni mici și a reține particulele coloidale și macromoleculele. Fluidul de dializat este separat de solventul pur printr-o membrană adecvată. Moleculele mici și ionii difuzează prin membrană în solvent și, cu înlocuirea sa suficient de frecventă, sunt îndepărtați aproape complet din lichidul dializabil. Permeabilitatea membranei față de substanțele cu greutate moleculară mică este determinată fie de faptul că moleculele mici și ionii trec liber prin capilarele care pătrund în membrană, fie se dizolvă în substanța membranei. Ca membrane pentru dializa se folosesc diverse filme, ca naturale - bovine sau porcine. vezica urinara, vezica natatoare pește și artificial - din nitroceluloză, acetat de celuloză, celofan, gelatină și alte materiale.
Membranele artificiale au un avantaj față de cele naturale prin faptul că pot fi preparate cu permeabilitati variate și foarte reproductibile. Atunci când alegeți un material pentru o membrană, este adesea necesar să se țină seama de încărcătura membranei într-un anumit solvent, care apare fie ca urmare a disocierii substanței membranei în sine, fie a adsorbției selective a ionilor pe aceasta, sau distribuția neuniformă a ionilor pe ambele părți ale membranei. Prezența unei sarcini pe membrană poate provoca uneori coagulareîn dializa soluțiilor coloidale, ale căror particule poartă o sarcină opusă în semn de sarcină a membranei. Suprafața membranelor de celofan și colodion din apă și soluții apoase este de obicei încărcată negativ. Membranele proteice într-un mediu cu un pH mai mic decât punctul izoelectric al proteinei sunt încărcate pozitiv, iar într-un mediu cu un pH ridicat - negativ.
Există o mare varietate de dializatoare - aparate pentru dializă. Toate dializatoarele sunt construite conform principiu general: Fluidul de dializat („fluidul interior”) se află într-un vas în care este separat de apă sau alt solvent („fluidul exterior”) printr-o membrană. Viteza de dializă crește odată cu creșterea suprafeței membranei, a porozității acesteia și a mărimii porilor, cu creșterea temperaturii, a intensității amestecării lichidului dializat, a vitezei de schimbare a fluidului extern și scade odată cu creșterea grosimea membranei.
Fig.31.1 . dializator: 1 - lichid dializabil; 2 - solvent; 3 - membrana de dializa; 4 - agitator
Electrodializa folosit pentru a crește viteza de dializă a electroliților cu greutate moleculară mică. În acest scop, în dializator se creează un câmp electric constant. Efectuarea dializei într-un câmp electric face posibilă accelerarea epurării unei soluții coloidale de câteva zeci de ori.
Dializa compensatorie sunt utilizate atunci când este necesar să se elibereze soluția coloidală doar de o parte a impurităților cu greutate moleculară mică. În dializator, solventul este înlocuit cu o soluție externă de substanțe cu greutate moleculară mică, care trebuie lăsată în soluția coloidală.
Una dintre varietățile de dializă compensatorie este hemodializa– purificarea sângelui cu ajutorul aparatului rinichi artificial. Sângele venos intră în contact prin membrană cu o soluție externă care conține substanțe în aceeași concentrație cu sângele care trebuie depozitate în sânge (zahăr, ioni de sodiu). În acest caz, sângele este purificat de toxine (uree, acid uric, bilirubină, amine, peptide, ioni de potasiu în exces), care trec prin membrană în soluția externă. Zahărul fără ser se determină prin dializa serică compensatorie împotriva soluției saline izotonice la care se adaugă diferite cantități de zahăr. Concentrația zahărului din ser fiziologic nu se modifică în timpul dializei doar atunci când este egală cu concentrația zahărului liber din sânge.
Ultrafiltrare utilizat pentru curățarea sistemelor care conțin particule coloidale (soluri, soluții DIU, suspensii de bacterii și viruși). Metoda se bazează pe forțarea amestecului să fie separat prin filtre cu pori care trec doar molecule și ioni de substanțe cu greutate moleculară mică. Într-o anumită măsură, ultrafiltrarea poate fi considerată ca o dializă sub presiune. Ultrafiltrarea este utilizată pe scară largă pentru purificarea apei, proteinelor, acizilor nucleici, enzimelor, vitaminelor, precum și în microbiologie atunci când se determină dimensiunea virusurilor și bacteriofagelor.
1. Clasificarea sistemelor disperse.
2. Metode de obţinere a sistemelor coloidale.
3. Metode de purificare a soluţiilor coloidale.
8. Stabilitatea și coagularea sistemelor coloidale.
Clasificarea sistemelor dispersate
dispersat numit sistem format dintr-o fază dispersată - un set de particule fragmentate și un mediu de dispersie continuă în care aceste particule sunt în suspensie.
Pentru a caracteriza fragmentarea fazei dispersate a fost introdus conceptul de grad de dispersie d, care se măsoară prin reciproca diametrului mediu, sau pentru particulele nesferice prin reciproca diametrului echivalent mediu. d(m -1):
Ulterior, ca măsură a fragmentării, s-a propus utilizarea suprafeței specifice (m -1):
unde S df - suprafață faza dispersata, Vdf- volumul fazei dispersate.
După gradul de dispersie, se disting grosier-dispersat și coloid-dispersat.
Clasificarea sistemelor dispersate în funcție de gradul de dispersie
Liber dispersat:
1) ultramicroeterogene ( coloidal adevărat) 10 -7 - 10 -5 cm (de la 1 la 100 microni) - - (t / t);
2) microeterogene 10 -5 - 10 -3cm. (de la 0,1 la 10 microni) t/w, w/w, g/l, t/g.
3) grosier > 10 -3cm; Multumesc
Sisteme de dispersie conectate:
1) microporoasă: pori până la 2 mm;
2) poros tranzitoriu: de la 2 la 200 mm;
3) macroporoasă: peste 200 mm.
În funcție de starea de agregare a fazei dispersate, se propune distingerea a opt tipuri coloidal sisteme.
Clasificarea dispersiilor după starea de agregare
|
Mediu de dispersie |
Faza dispersivă |
Simbol |
Numele sistemului și exemple |
|
sisteme solide eterogene: aliaje, materiale compozite (beton, cermet) |
|||
|
sisteme capilare, emulsii solide: lichide în corpuri poroase, soluri, grunduri, perle |
|||
|
gazos |
corpuri poroase, spume solide: adsorbanți și catalizatori în gaze, piatră ponce, pâine |
||
|
suspensii si soluri: var, paste, limoluri |
|||
|
emulsii: ulei, creme, lapte |
|||
|
gazos |
emulsii gazoase si spume: flotatie, stingere incendii, spume de sapun |
||
|
gazos |
gazos |
aerosoli: fum, pulberi, praf aerosoli: ceata, nori Neformat |
G. Freindlich a propus apelarea sistemelor cu interacțiune slabă între faza dispersată și mediul de dispersie coloizi liofobi (soluri), cu interacțiune puternică liofilă.
Dacă mediul de dispersie este apă, atunci sistemele sunt numite corespunzător hidrofobși hidrofil.
Încă de la începutul secolului al XX-lea. s-a constatat că coloizii liofobi sunt ireversibil(după îndepărtarea mediului de dispersie, ei sunt spontan incapabili să se disperseze și să dea un sol) și liofili - reversibil sisteme (capabile de dizolvare spontană).
Dacă într-un sistem coloidal există legături stabile între particulele fazei dispersate, atunci astfel de sisteme se numesc conectate dispersate(geluri), în absența legăturilor - liber dispersate(soluții coloidale).
2. Metode de obţinere a sistemelor coloidale
Deoarece sistemele coloidale ocupă o poziție intermediară între sistemele dispersate grosier și soluțiile adevărate în ceea ce privește dimensiunea particulelor, metodele de preparare a acestora pot fi împărțite în două grupe: dispersive și de condensare.
Metode de dispersie bazată pe măcinarea fazei dispersate. Dispersia cu formarea sistemelor coloidale liofile are loc spontan din cauza mișcării termice. Formarea sistemelor coloidale liofobe necesită energie. Pentru a obține gradul necesar de dispersie, aplicați:
Concasare mecanică cu mori cu bile sau coloidale;
Slefuire cu ultrasunete;
Dispersie electrică (pentru obținerea solurilor metalice);
Dispersie chimică (peptizare).
Dispersia este efectuată în general în prezența unui stabilizator. Acesta poate fi un exces de unul dintre reactivi, surfactanți, proteine, polizaharide.
Metode de condensare constau în interacțiunea moleculelor de soluție adevărată cu formarea de particule de dimensiuni coloidale, care poate fi realizată atât prin metode fizice, cât și chimice.
Metoda fizică este o metodă de înlocuire a solventului (de exemplu, se adaugă apă într-o soluție adevărată de colofoniu în alcool, apoi alcoolul este îndepărtat).
Condensarea chimică constă în obţinerea de soluţii coloidale prin reacții chimice cu formarea de compuși puțin solubili:
AgNO 3 + KI \u003d AgI (t) + KNO 3
2HAuCl 4 + 3H 2 O \u003d 2Au (t) + 8HCl + 3O 2
Soluțiile stoc trebuie diluate și să conțină un exces de unul dintre reactivi.
3. Metode de purificare a soluţiilor coloidale
Dacă soluțiile coloidale conțin impurități de substanțe dizolvate cu greutate moleculară mică și particule grosiere, atunci prezența lor poate afecta negativ proprietățile solurilor, reducându-le stabilitatea.
Pentru a purifica soluțiile coloidale de impurități, filtrare, dializa, electrodializa, ultrafiltrare.
Filtrare se bazează pe capacitatea particulelor coloidale de a trece prin porii filtrelor convenționale. În acest caz, particulele mai mari sunt reținute. Filtrarea este utilizată pentru a purifica soluțiile coloidale din impuritățile particulelor grosiere.
Dializă- îndepărtarea cu ajutorul membranelor a compuşilor cu molecul scăzut din soluţiile coloidale şi soluţiile DIU. În acest caz, proprietatea membranelor este folosită pentru a trece molecule și ioni mici și a reține particulele coloidale și macromoleculele. Fluidul de dializat este separat de solventul pur printr-o membrană adecvată. Moleculele mici și ionii difuzează prin membrană în solvent și, cu înlocuirea sa suficient de frecventă, sunt îndepărtați aproape complet din lichidul dializabil. Permeabilitatea membranei față de substanțele cu greutate moleculară mică este determinată fie de faptul că moleculele mici și ionii trec liber prin capilarele care pătrund în membrană, fie se dizolvă în substanța membranei. Ca membrane pentru dializă se folosesc diverse filme, atât naturale - vezică bovină sau porcină, vezică natatoare a peștilor, cât și artificiale - din nitroceluloză, acetat de celuloză, celofan, gelatină și alte materiale.
Membranele artificiale au un avantaj față de cele naturale prin faptul că pot fi preparate cu permeabilitati variate și foarte reproductibile. Atunci când alegeți un material pentru o membrană, este adesea necesar să se țină seama de încărcătura membranei într-un anumit solvent, care apare fie ca urmare a disocierii substanței membranei în sine, fie a adsorbției selective a ionilor pe aceasta, sau distribuția neuniformă a ionilor pe ambele părți ale membranei. Prezența unei sarcini pe membrană poate provoca uneori coagulareîn dializa soluțiilor coloidale, ale căror particule poartă o sarcină opusă în semn de sarcină a membranei. Suprafața membranelor de celofan și colodion din apă și soluții apoase este de obicei încărcată negativ. Membranele proteice într-un mediu cu un pH mai mic decât punctul izoelectric al proteinei sunt încărcate pozitiv, iar într-un mediu cu un pH ridicat - negativ.
Există o mare varietate de dializatoare - aparate pentru dializă. Toate dializatoarele sunt construite după principiul general: fluidul de dializat („fluidul interior”) este conținut într-un vas în care este separat de apă sau alt solvent („fluidul exterior”) printr-o membrană. Viteza de dializă crește odată cu creșterea suprafeței membranei, a porozității acesteia și a mărimii porilor, cu creșterea temperaturii, a intensității amestecării lichidului dializat, a vitezei de schimbare a fluidului extern și scade odată cu creșterea grosimea membranei.

Fig.31.1 . dializator: 1 - lichid dializabil; 2 - solvent; 3 - membrana de dializa; 4 - agitator
Electrodializa folosit pentru a crește viteza de dializă a electroliților cu greutate moleculară mică. În acest scop, în dializator se creează un câmp electric constant. Efectuarea dializei într-un câmp electric face posibilă accelerarea epurării unei soluții coloidale de câteva zeci de ori.
Dializa compensatorie sunt utilizate atunci când este necesar să se elibereze soluția coloidală doar de o parte a impurităților cu greutate moleculară mică. În dializator, solventul este înlocuit cu o soluție externă de substanțe cu greutate moleculară mică, care trebuie lăsată în soluția coloidală.
Una dintre varietățile de dializă compensatorie este hemodializa– purificarea sângelui cu ajutorul aparatului rinichi artificial. Sângele venos intră în contact prin membrană cu o soluție externă care conține substanțe în aceeași concentrație cu sângele care trebuie depozitate în sânge (zahăr, ioni de sodiu). În acest caz, sângele este purificat de toxine (uree, acid uric, bilirubină, amine, peptide, ioni de potasiu în exces), care trec prin membrană în soluția externă. Zahărul fără ser se determină prin dializa serică compensatorie împotriva soluției saline izotonice la care se adaugă diferite cantități de zahăr. Concentrația zahărului din ser fiziologic nu se modifică în timpul dializei doar atunci când este egală cu concentrația zahărului liber din sânge.
Ultrafiltrare utilizat pentru curățarea sistemelor care conțin particule coloidale (soluri, soluții DIU, suspensii de bacterii și viruși). Metoda se bazează pe forțarea amestecului să fie separat prin filtre cu pori care trec doar molecule și ioni de substanțe cu greutate moleculară mică. Într-o anumită măsură, ultrafiltrarea poate fi considerată ca o dializă sub presiune. Ultrafiltrarea este utilizată pe scară largă pentru purificarea apei, proteinelor, acizilor nucleici, enzimelor, vitaminelor, precum și în microbiologie atunci când se determină dimensiunea virusurilor și bacteriofagelor.
4. Proprietăţi molecular-cinetice ale sistemelor coloidale
Cinetică moleculară numite proprietăți care sunt asociate cu mișcarea termică haotică a particulelor. Acestea includ - Mișcarea browniană, difuzie, presiune osmotică, sedimentare. Aceste proprietăți sunt determinate de dimensiunea particulelor și de compoziția lor fracționată.
Mișcarea browniană – mișcarea haotică a particulelor din faza dispersată sub acțiunea impactului particulelor din mediul de dispersie. Acest tip de mișcare este tipic pentru particulele cu dimensiuni< 10 -6 м. Если размеры частиц дисперсной среды больше, то частицы лишь колеблются. Интенсивность броуновского движения зависит от размера частиц, температуры, вязкости дисперсионной среды.
Difuzie - procesul de transfer spontan al materiei datorat miscarii termice, care duce la egalizarea concentratiilor sau la stabilirea concentratiilor de echilibru. Difuzia are o anumită rată, care este determinată de legea lui Fick:
Viteza de difuzie este direct proporțională cu diferența de concentrații și cu suprafața prin care are loc difuzia..
![]() , Unde
, Unde
– viteza de difuzie, kg/s
S este aria suprafeței,
- gradient de concentrație, kg/m 4
D - coeficientul de difuzie, m 2 / s
D este o valoare determinată experimental.
unde k b este constanta Boltzmann;
r este raza particulei;
h este vâscozitatea mediului.
Presiune osmotica respectă legea van't Hoff:
![]() , Unde
, Unde
C n - concentrația parțială, m -3 - numărul de particule pe unitate de volum, este determinat de raportul dintre masa fazei dispersate și masa particulei coloidale.
Presiunea osmotică a soluțiilor coloidale este de 1000 de ori mai mică decât presiunea osmotică a soluțiilor adevărate.
Sedimentare - procesul de decantare a particulelor din faza dispersată sub acţiunea gravitaţiei sau a forţelor centrifuge.
Viteza de decantare a particulelor sub acțiunea gravitației poate fi estimată prin formula:
 , Unde
, Unde
u - rata de decontare
r este raza particulei fazei dispersate
h este vâscozitatea mediului
r, r 0 sunt densitățile fazei dispersate și, respectiv, ale mediului de dispersie.
Astfel, rata de decantare este direct proporţională cu r 2 . Particulele de sisteme grosier dispersate se depun într-un ritm vizibil. Prin urmare, sistemele grosier dispersate nu sunt stabile în ceea ce privește sedimentarea. Particulele de dimensiuni coloidale practic nu se depun sub acțiunea gravitației și sunt stabile la sedimentare. De exemplu, timpul necesar pentru ca particulele de cuarț cu o rază de 10 ~ 8 m să se depună în apă la o distanță de 10 ~ 2 m este de 359 de zile.
Pentru sedimentarea particulelor coloidale se folosește ultracentrifugarea. Așa se studiază sedimentarea proteinelor și a virusurilor.
Stabilirea ratei de decontare este baza analiza sedimentarii, cu care puteți determina dimensiunea particulelor și compoziția lor fracționată - numărul de particule de diferite dimensiuni. Analiza de sedimentare este utilizată pe scară largă pentru evaluarea calitativă a stării funcționale a eritrocitelor. Viteza de sedimentare a eritrocitelor (VSH) se modifică semnificativ în diferite boli și permite medicului să tragă o concluzie despre starea corpului pacientului.
5. Proprietăţi optice ale sistemelor dispersate
În funcție de raportul dintre diametru 2 r particulele fazei dispersate și lungimea de undă l care trec prin sistemul dispersat, proprietățile optice ale sistemului se modifică.
Dacă 2r este mult mai mare l, Aceasta este în principal reflectarea, refracția și absorbția luminii. Ca rezultat, sistemele grosiere prezintă turbiditate atât în lumina transmisă, cât și atunci când sunt iluminate din lateral.
Pentru sisteme dispersate în coloizi 2r » l de lumină incidentă. În acest caz, împrăștierea difractivă a luminii domină, când fiecare particulă coloidală devine o sursă de lumină secundară. observat vizual opalescență. Acest fenomen constă în faptul că culoarea soluțiilor coloidale în lumina împrăștiată (când sunt privite din lateral) și în lumina transmisă nu este aceeași.

Opalescența a fost observată pentru prima dată independent una de alta în 1857 de M. Faraday și în 1868 de J. Tyndall (1820-1893). Prin urmare, fenomenul se numește efect Faraday-Tyndall. Privit din lateral (a), un con opalescent, numit și con Faraday-Tyndall, este clar vizibil (1 - sursă de lumină, 2 - soluție coloidală (negru în figură), 3 - direcția de observare).
Intensitatea împrăștierii luminii depinde de un număr de factori și este cuantificată prin ecuația derivată de Rayleigh:

unde I, I 0 - intensitatea luminii împrăștiate și incidente, W/m2;
k p constantă de Rayleigh, în funcţie de raportul indicilor de refracţie ai fazei dispersate şi a mediului de dispersie, m3;
c n - concentrația parțială a solului, m;
l - lungimea de undă a luminii incidente, m;
r - raza particulei, m
Din ecuația Rayleigh rezultă că intensitatea luminii împrăștiate este direct proporțională cu intensitatea luminii incidente, concentrația parțială a solului și pătratul volumului particulei coloidale și este reversibil proporțională cu puterea a patra. a lungimii de undă a luminii incidente.
Fenomenul de împrăștiere prin difracție a luminii stă la baza designului ultramicroscopului. Ultramicroscop - instrument optic, ceea ce face posibilă detectarea particulelor de până la 10 -9 m în dimensiune, invizibile într-un microscop convențional (până la 10 -7 m). Observațiile sunt efectuate în direcția perpendiculară pe direcția fasciculului de lumină, adică. în lumină împrăștiată. Într-un ultramicroscop, nu particulele în sine sunt vizibile, ci pete mari de difracție a luminii pe ele. Ultramicroscopia este utilizată pentru a studia plasma și serul de sânge, limfa și vaccinuri.
6. Proprietăţi electrice ale sistemelor disperse
Proprietățile electrocinetice ale sistemelor coloidale sunt proprietăți care se datorează prezenței unei sarcini a mediului de dispersie și a particulelor fazei dispersate și apar atunci când se mișcă unul față de celălalt.
electroforeză– mișcarea particulelor fazei dispersate în raport cu un mediu de dispersie staționar sub acțiunea unei diferențe de potențial extern.
Electroforeza este similară cu electroliza. Diferențele sunt cantitative: în timpul electroforezei, cantități mult mai mari de substanță se mișcă. Aplicarea electroforezei: separarea proteinelor și a acizilor nucleici; determinarea sarcinii particulelor fazei dispersate și a potențialului electrocinetic.
Potenţial de sedimentare este diferența de potențial care apare atunci când particulele fazei dispersate se mișcă sub acțiunea gravitației sau a forțelor centrifuge.
Electroosmoza– mișcarea particulelor de mediu de dispersie față de faza staționară dispersă sub acțiunea unei diferențe de potențial extern.
Electroosmoza se observă în sistemele legate-dispersate, când faza dispersată este un corp poros, capilare subțiri umplute cu un mediu de dispersie lichid. Aplicarea electroosmozei: deshidratarea corpurilor poroase.
potenţial de curgere- diferenta de potential care apare atunci cand un lichid curge in capilare sau corpuri poroase cand se aplica o diferenta de presiune.
7. Structura particulelor coloidale - micelii
Particulele coloidale sunt formațiuni complexe - milella . Să luăm în considerare structura particulelor de sol AgI obținute prin interacțiunea azotatului de argint cu un exces de iodură de potasiu.
O micelă este compusă dintr-un neutru electric unitateși parte ionogene. Partea ionogene a unei micele este împărțită în adsorbţieși difuziune straturi. Unitatea dobândește o sarcină ca urmare a adsorbției selective a ionilor sau a ionizării suprafeței. Ionii care determină sarcina agregatului se numesc potenţial-determinant. Agregatul și ionii care determină potențialul formează nucleul. Un anumit număr de ioni de semn opus sunt asociați stabil cu suprafața încărcată a nucleului - contraionii. Ionii determinanți de potențial și unii contraioni formează un strat de adsorbție. Unitatea împreună cu stratul de adsorbție se numește granule. Cealaltă parte a contraionilor se formează difuziune un strat a cărui densitate scade odată cu distanța de la miez. Sarcina granulei este egală cu suma încărcărilor ionilor contra și potențial determinanți.

Ca rezultat, pe suprafața micelului apar un dublu strat electric și o diferență de potențial între particulele fazei dispersate și mediul de dispersie. Acest potențial se numește potențial electrotermodinamic.

La deplasarea fazei dispersate în raport cu mediul de dispersie, suprafața de alunecare trece de-a lungul interfeței dintre straturile de adsorbție și difuzie. Viteza de mișcare depinde de fazele una față de alta este determinată de valoarea potențialului de pe suprafața de alunecare, care se numește electrocinetice sau x (zetta)-potenţial. Valoarea potenţialului x depinde de valoarea potenţialului electrotermodinamic total şi de grosimea stratului de difuzie. Grosimea stratului de difuzie depinde de concentrația de electrolit din soluția coloidală: pe măsură ce concentrația de electrolit crește, contraionii sunt deplasați din stratul de difuzie în stratul de adsorbție. Grosimea stratului de difuzie scade, iar potențialul x scade. La o anumită concentrație de electroliți, toți contraionii sunt deplasați în stratul de adsorbție. În acest caz, potențialul x devine egal cu 0 și sarcina particulei coloidale este egală cu 0. Această stare a particulei coloidale se numește stare izoelectrică.
8. Stabilitatea și coagularea sistemelor coloidale
Sistemele coloidale sunt instabile termodinamic, deoarece au un exces de energie de suprafață Gibbs. Cu toate acestea, în anumite condiții, sistemele coloidale sunt stabile, adică dimensiunea și concentrația particulelor coloidale pot rămâne neschimbate. Există două tipuri de stabilitate a sistemelor coloidale: sedimentareși agregativ.
Rezistenta la sedimentare (cinetic) - rezistența particulelor coloidale la decantare. Această stabilitate depinde de mărimea particulelor și de vâscozitatea mediului.
Stabilitate agregativă – capacitatea particulelor din faza dispersată de a contracara coagularea (lipirea împreună în agregate mai mari). O scădere a stabilității agregative înseamnă o scădere a stabilității sedimentării.
Sistemele coloidale liofobe sunt instabile agregativ, în timp ce cele liofile sunt stabile. Cele liofobe pot exista cu condiția să fie stabilizate. Există doi factori principali în stabilizarea sistemelor coloidale liofobe: electric factor și structural-mecanic factor.
Factorul electric stabilizarea este asociată cu existența unui dublu strat electric la interfață. Deși micela în ansamblu este neutră din punct de vedere electric, particulele coloidale au aceleași sarcini, iar straturile de difuzie au aceleași sarcini. Prezența unor straturi încărcate similar împiedică particulele să se apropie de o astfel de distanță la care încep să acționeze forțele atractive. În consecință, o scădere a grosimii stratului de difuzie încalcă stabilizarea electrică, iar particulele se apropie între ele la o astfel de distanță încât atracția lor este posibilă, ceea ce duce la lipindu-se împreunăși coagulare. Încălcarea stabilizării electrice are loc atunci când electroliții sunt adăugați la soluțiile coloidale.
Se numește concentrația minimă de electrolit care provoacă coagularea unei soluții coloidale pragul de coagulare. Pragul de coagulare depinde de sarcina ionului de coagulare, care are o sarcină opusă celei a particulei coloidale.
regulă Schultz-Hardy: Capacitatea de coagulare a electrolitului crește odată cu creșterea sarcinii ionului de coagulare
unde C p este pragul de coagulare (cea mai mică concentrație de electrolit la care are loc coagularea);
z este sarcina ionului de coagulare.
Când amestecați două soluții coloidale cu particule încărcate opus, coagularea reciprocăîn cazul în care sarcinile lor totale se neutralizează reciproc.
Factorul structural-mecanic stabilizarea sistemelor coloidale are loc ca urmare a adsorbției pe suprafața particulelor coloidale ale agenților tensioactivi sau compușilor cu molecul mare (proteine, polizaharide). Particulele adsorbite (agenți tensioactivi sau molecule de polimer) formează un strat mecanic puternic care împiedică lipirea particulelor. Aceste substanțe fac, de asemenea, suprafața particulelor liofilă. Această metodă de stabilizare a sistemelor coloidale se numește protectie coloidala, și substanțele folosite pentru stabilizare coloizi protectori.
Fluidele biologice conțin astfel de coloizi de protecție care împiedică precipitarea unor substanțe slab solubile precum fosfatul și carbonatul de calciu și unii metaboliți insolubili. Acest lucru previne depunerea de săruri în ateroscleroză, gută, formarea de litiază renală și biliară.
Formarea unei soluții coloidale dintr-un precipitat se numește peptizare,și substanțe care provoacă peptizare - peptizatoare. Electroliții sau agenții tensioactivi sunt utilizați ca peptizanți. Ionii sau moleculele de peptizanți, fiind adsorbiți pe suprafața particulelor de sedimente, formează un dublu strat electric sau o înveliș de solvat, ceea ce duce la depășirea forțelor de atracție intermoleculară dintre ele.
9. Sisteme coloidale liofile. Surfactanți coloidali
Când moleculele de surfactant amfifil cu un radical hidrocarburic lung (C 10 - C 22) sunt dizolvate în apă, se stabilește un echilibru între soluția adevărată și cea coloidală.

Se numesc surfactanți capabili să formeze micele în soluție surfactanți coloidali. Echilibrul dintre soluțiile adevărate și coloidale depinde de concentrația surfactantului.
Cea mai mică concentrație la care este posibilă micelizarea se numește concentrație critică micelară (CMC).
CMC depinde de temperatură, lungimea lanțului de hidrocarburi și concentrația de electroliți din soluție. Odată cu creșterea temperaturii, CMC crește; cu creșterea lungimii lanțului de hidrocarburi, scade; cu creșterea concentrației de electrolit în soluție, scade și el.
În timpul formării micelelor, proprietățile soluțiilor, în funcție de numărul de particule, se modifică brusc: presiunea osmotică, conductivitatea electrică. O schimbare bruscă a acestor proprietăți face posibilă determinarea CMC.
Întrebări pentru autocontrol
- Metodele de obținere a sistemelor dispersate prin condensare fizică includ .... (formarea unei substanțe slab solubile, înlocuirea solventului, măcinarea fină a materialelor dure , condensarea vaporilor)
- Difuzia unidirecțională a moleculelor de solvent printr-o membrană semi-permeabilă într-o soluție coloidală se numește ... (dizolvare, presiune osmotică, dializă, osmoză)
- Sistemele dispersate cu o fază dispersată tridimensională includ... cafea instant, lapte, peliculă de ulei pe suprafața apei, lemn.
- O trăsătură caracteristică a obiectelor studiate în chimia coloidală este... eterogenitate.
- Un exemplu de sistem în care mediul de dispersie și faza dispersată sunt lichide este (ceață, aerosoli, maioneză, jeleu)
- Soluția coloidală este formată din... dispersie și condensare
- Pentru a purifica soluțiile coloidale de impuritățile ionice, metoda este utilizată ... .. electrodializa
- În cazul în care un ape uzate conțin agenți tensioactivi de natură anionică, atunci soluția (sulfat de aluminiu, fosfat de sodiu, clorură de calciu, sulfat de amoniu) va avea cea mai mare capacitate de coagulare.
- În natură, dispersia substanțelor, însoțită de formarea de sisteme dispersate, are loc ... când corpurile de apă îngheață, în timpul inundațiilor, în timpul erupției vulcanice, în timpul precipitațiilor
- Stratul de adsorbție al contraionilor în formula micelilor de iodură de argint ……………( (n-x)K +, m, nI - , xK +)
- La caracteristici cantitative sisteme dispersate se referă … dispersie(nu numărul de particule pe unitate de volum)
- Particula coloidală obținută prin interacțiunea sulfatului de potasiu cu un exces de clorură de bariu are o sarcină …(pozitiv)
- O particulă coloidală formată prin interacțiunea azotatului de argint și a unui exces de iodură de potasiu într-un câmp electric; trece la catod, la anod, nu se mișcă, oscilează.
- Odată cu creșterea sarcinii ionului de coagulare, capacitatea sa de coagulare ... ( scade, crește, nu se schimbă, se schimbă ambiguu)
- Procesul de flotare se bazează pe diverse substanțe ______________________ lichide ( precipitare, evaporare, dizolvare, umectare)
- Conform teoriei structurii soluțiilor coloidale, combinația dintre o particule coloidale și un strat de difuzie de ioni formează o particulă neutră din punct de vedere electric, care se numește ..... micelă.
- Un ion, atunci când este adăugat la un sistem coloidal, are loc distrugerea acestuia se numește .... Coagularea.
- Se numește fenomenul de transfer al particulelor fazei dispersate într-un câmp electric constant …. Electroosmoza, electroliza, potentialul de curgere, electroforeza.
- Cel mai mare efect de coagulare în timpul formării eolului AgI din volume egale dintr-o soluție de AgNO3 0,02 M și o soluție de KI 0,01 M este exercitat de ionul... (K+, Ca2+, SO42-, CI-)
- Pentru un sol obținut prin reacția 2Na 2 SiO 3 (ex) + 2HCl \u003d H 2 SiO 3 + 2NaCl, ionul ... (Cu 2+, Fe 3+, K +, Zn 2+) va avea cel mai bun efect de coagulare