ฮอร์โมน Gonadotropic: FSH, LH, LTH ฮอร์โมน Gonadotropic และหน้าที่ของฮอร์โมน Gonadotropic หน้าที่ Gonadotropic ของต่อมใต้สมองนั้น
Gonadotropin-releasing hormone (GnRH) หรือที่รู้จักในชื่อ luteinizing hormone-releasing hormone (LHRH) และ luliberin เป็นฮอร์โมนเปปไทด์ในโภชนาการที่มีหน้าที่ในการปล่อยฮอร์โมนกระตุ้นรูขุมขน (FSH) และฮอร์โมน luteinizing (LH) จาก adenohypophysis GnRH ถูกสังเคราะห์และปล่อยออกมาจากเซลล์ประสาท GnRH ในไฮโปทาลามัส เปปไทด์อยู่ในตระกูลของฮอร์โมนที่ปล่อย gonadotropin มันแสดงถึงระยะเริ่มต้นของระบบแกน hypothalamic-pituitary-adrenal
โครงสร้าง
ลักษณะเฉพาะของ GnRH ได้รับการขัดเกลาในปี 1977 โดยผู้ได้รับรางวัลโนเบล Roger Guillemin และ Andrew W. Schally: pyroGlu-His-Trp-Ser-Tyr-Gly-Lay-Arg-Pro-Gly-NH2 ตามปกติสำหรับเป็นตัวแทนของเปปไทด์ ลำดับจะได้รับจากปลาย N ถึงปลาย C; นอกจากนี้ยังเป็นมาตรฐานที่จะละเว้นสัญกรณ์ chirality โดยสันนิษฐานว่ากรดอะมิโนทั้งหมดอยู่ในรูปแบบ L ตัวย่อหมายถึงกรดอะมิโนที่สร้างโปรตีนมาตรฐาน ยกเว้น pyroGlu, กรดไพโรกลูตามิก ซึ่งเป็นอนุพันธ์ของกรดกลูตามิก NH2 ที่ปลาย C บ่งชี้ว่าแทนที่จะลงท้ายด้วยคาร์บอกซีเลตอิสระ โซ่จะสิ้นสุดด้วยคาร์บอกซาไมด์
สังเคราะห์
ยีนตั้งต้น GNRH1 สำหรับ GnRH อยู่บนโครโมโซม 8 ในสัตว์เลี้ยงลูกด้วยนม เทอร์มินอลดีคาเปปไทด์ปกติถูกสังเคราะห์จากกรดพรี-โปรฮอร์โมน 92 อะมิโนในพรีออปติกส่วนหน้าไฮโปทาลามัส เป็นเป้าหมายของกลไกการกำกับดูแลต่าง ๆ ของระบบแกน hypothalamic-pituitary-adrenal ซึ่งถูกยับยั้งโดยการเพิ่มระดับของฮอร์โมนเอสโตรเจนในร่างกาย
ฟังก์ชั่น
GnRH ถูกหลั่งเข้าสู่การไหลเวียนของต่อมใต้สมองของหลอดเลือดดำพอร์ทัลที่ค่ามัธยฐาน การไหลเวียนของหลอดเลือดดำพอร์ทัลจะนำ GnRH ไปยังต่อมใต้สมองซึ่งประกอบด้วยเซลล์ gonadotropic โดยที่ GnRH กระตุ้นตัวรับของตัวเอง ตัวรับฮอร์โมนที่ปล่อย gonadotropin เจ็ด G-protein ควบคู่ไปกับ transmembrane receptors ซึ่งกระตุ้น beta isoform ของ phosphoinositide phospholipase C ซึ่ง ดำเนินการระดมแคลเซียมและโปรตีนไคเนสซี สิ่งนี้นำไปสู่การกระตุ้นโปรตีนที่เกี่ยวข้องกับการสังเคราะห์และการหลั่งของ gonadotropins LH และ FSH GnRH ถูกตัดขาดระหว่างการสลายโปรตีนภายในไม่กี่นาที กิจกรรม GnRH ต่ำมากในช่วงวัยเด็ก และเพิ่มขึ้นในช่วงวัยแรกรุ่นหรือวัยรุ่น ในช่วงเวลาของการสืบพันธุ์ กิจกรรมของ pulsatile มีความสำคัญต่อการทำงานของการสืบพันธุ์ที่ประสบความสำเร็จภายใต้การควบคุมของวงจรป้อนกลับ อย่างไรก็ตาม ไม่จำเป็นต้องมีกิจกรรม GnRH ในระหว่างตั้งครรภ์ กิจกรรมการเต้นเป็นจังหวะอาจลดลงในโรคของมลรัฐและต่อมใต้สมองหรือด้วยความผิดปกติของมัน (เช่นการปราบปรามการทำงานของมลรัฐ) หรือเนื่องจากความเสียหายทางอินทรีย์ (การบาดเจ็บ, เนื้องอก) ระดับโปรแลคตินที่เพิ่มขึ้นจะลดการทำงานของ GnRH ในทางกลับกัน hyperinsulinemia จะเพิ่มกิจกรรม pulsatile ส่งผลให้กิจกรรม LH และ FSH บกพร่องตามที่เห็นในกลุ่มอาการรังไข่แบบ polycystic การสังเคราะห์ GnRH นั้นไม่มีมาแต่กำเนิดในกลุ่มอาการ Kallmann
ระเบียบ FSH และ LH
ในต่อมใต้สมอง GnRH ช่วยกระตุ้นการสังเคราะห์และการหลั่งของ gonadotropins, ฮอร์โมนกระตุ้นรูขุมขน (FSH) และฮอร์โมน luteinizing (LH) กระบวนการเหล่านี้ถูกควบคุมโดยขนาดและความถี่ของพัลส์ที่ปล่อย GnRH เช่นเดียวกับผลป้อนกลับจากแอนโดรเจนและเอสโตรเจน พัลส์ GnRH ความถี่ต่ำทำให้เกิดการปลดปล่อย FSH ในขณะที่พัลส์ GnRH ความถี่สูงกระตุ้นการปลดปล่อย LH มีความแตกต่างในการหลั่ง GnRH ระหว่างผู้หญิงและผู้ชาย ในผู้ชาย GnRH จะถูกหลั่งออกมาเป็นพัลส์ในอัตราคงที่ ในขณะที่ในผู้หญิง อัตราการเต้นของชีพจรจะแตกต่างกันไปในระหว่างรอบประจำเดือน และมีชีพจร GnRH ขนาดใหญ่ก่อนการตกไข่ การหลั่งของ GnRH สามารถกระตุ้นได้ในสัตว์มีกระดูกสันหลังทั้งหมด [ขณะนี้ยังไม่มีหลักฐานสำหรับความถูกต้องของข้อความนี้ - มีเพียงหลักฐานสนับสนุนเชิงประจักษ์สำหรับสัตว์เลี้ยงลูกด้วยนมจำนวนน้อยเท่านั้น] และจำเป็นต่อการรักษาฟังก์ชันการสืบพันธุ์ตามปกติ ดังนั้น GnRH1 ฮอร์โมนตัวเดียวจึงควบคุมกระบวนการที่ซับซ้อนของการเจริญเติบโตของฟอลลิคูลาร์ การตกไข่ และการพัฒนาคอร์ปัส ลูเทียมในสตรี เช่นเดียวกับการสร้างสเปิร์มในผู้ชาย
ฮอร์โมนประสาท
GnRH หมายถึง neurohormones ฮอร์โมนที่ผลิตในเซลล์ประสาทจำเพาะและปล่อยออกมาจากปลายประสาทของพวกมัน พื้นที่สำคัญของการผลิต GnRH คือพื้นที่พรีออปติกของมลรัฐซึ่งมีเซลล์ประสาทส่วนใหญ่ที่หลั่ง GnRH เซลล์ประสาทที่หลั่ง GnRH เกิดขึ้นที่เนื้อเยื่อจมูกและย้ายไปที่สมอง โดยกระจายไปในผนังกั้นตรงกลางและส่วนไฮโปทาลามัส และเชื่อมต่อกันด้วยเดนไดรต์ที่ยาวมาก (มากกว่า 1 มม.) รวมเข้าด้วยกันเพื่อแบ่งปันอินพุต synaptic ทั่วไป ซึ่งช่วยให้พวกเขาสามารถซิงโครไนซ์การปล่อย GnRH เซลล์ประสาทที่หลั่ง GnRH ถูกควบคุมโดยเซลล์ประสาทอวัยวะต่าง ๆ ผ่านเครื่องส่งสัญญาณที่แตกต่างกันหลายตัว (รวมถึง norepinephrine, GABA, กลูตาเมต) ตัวอย่างเช่น โดปามีนกระตุ้นการปลดปล่อย LH (ผ่านทาง GnRH) ในสตรีหลังการให้ฮอร์โมนเอสโตรเจน-โปรเจสเตอโรน โดปามีนอาจยับยั้งการหลั่ง LH ในสตรีหลังการผ่าตัดรังไข่ Kiss-peptin เป็นตัวควบคุมที่สำคัญของการปล่อย GnRH ซึ่งสามารถควบคุมได้ด้วยฮอร์โมนเอสโตรเจน มีการตั้งข้อสังเกตว่ามีเซลล์ประสาทที่หลั่งคิสเปปตินซึ่งแสดงอัลฟาของตัวรับเอสโตรเจนด้วย
อิทธิพลต่ออวัยวะอื่นๆ
พบ GnRH ในอวัยวะอื่นนอกเหนือจากไฮโปทาลามัสและต่อมใต้สมอง แต่บทบาทของมันในกระบวนการอื่นๆ ของชีวิตยังไม่เป็นที่เข้าใจ ตัวอย่างเช่น GnRH1 มีแนวโน้มที่จะส่งผลต่อรกและต่อมเพศ นอกจากนี้ยังพบตัวรับ GnRH และ GnRH ในเซลล์มะเร็งเต้านม รังไข่ ต่อมลูกหมาก และเยื่อบุโพรงมดลูก
ผลกระทบต่อพฤติกรรม
การผลิต/การเปิดตัวมีอิทธิพลต่อพฤติกรรม ปลาหมอสีซึ่งแสดงกลไกการครอบงำทางสังคมในทางกลับกันจะมีการควบคุมการหลั่ง GnRH ในขณะที่ปลาหมอสีซึ่งต้องพึ่งพาสังคมมีการควบคุมการหลั่ง GnRH ที่ลดลง นอกจากการหลั่งแล้ว สภาพแวดล้อมทางสังคมและพฤติกรรมยังมีอิทธิพลต่อขนาดของเซลล์ประสาทที่หลั่ง GnRH โดยเฉพาะอย่างยิ่ง เพศผู้ที่ถูกแยกออกจากกันมากกว่าจะมีเซลล์ประสาทที่หลั่ง GnRH ที่ใหญ่กว่าตัวผู้ที่ถูกแยกออกจากกันน้อยกว่า ความแตกต่างยังพบได้ในเพศหญิง โดยที่ตัวเมียที่ผสมพันธุ์จะมีเซลล์ประสาทที่หลั่ง GnRH ที่เล็กกว่าตัวเมียที่ควบคุม ตัวอย่างเหล่านี้ชี้ให้เห็นว่า GnRH เป็นฮอร์โมนที่ควบคุมโดยสังคม
แอปพลิเคชันทางการแพทย์
ก่อนหน้านี้ Natural GnRH ถูกกำหนดให้เป็น gonadorelin hydrochloride (Factrel) และ gonadorelin diacetatetetrahydrate (Cistorelin) สำหรับการรักษาโรคของมนุษย์ การปรับเปลี่ยนโครงสร้างของเดคาเปปไทด์ GnRH เพื่อเพิ่มครึ่งชีวิตได้นำไปสู่การสร้างสารอะนาล็อกของ GnRH1 ที่กระตุ้น (ตัวเร่งปฏิกิริยา GnRH1) หรือการยับยั้ง (ตัวต้าน GnRH) โกนาโดโทรปิน แอนะล็อกสังเคราะห์เหล่านี้ได้เข้ามาแทนที่ฮอร์โมนธรรมชาติสำหรับการใช้ทางคลินิก อะนาล็อก leuprorelin ใช้เป็นยาอย่างต่อเนื่องในการรักษามะเร็งเต้านม เยื่อบุโพรงมดลูกเจริญผิดที่ มะเร็งต่อมลูกหมาก และหลังการศึกษาในช่วงทศวรรษ 1980 มีการใช้โดยนักวิจัยหลายคน รวมทั้ง Dr. Florence Comit จาก Yale University เพื่อรักษาวัยแรกรุ่นแก่แดด
พฤติกรรมทางเพศของสัตว์
กิจกรรม GnRH ส่งผลต่อความแตกต่างในพฤติกรรมทางเพศ ระดับ GnRH ที่เพิ่มขึ้นช่วยเพิ่มพฤติกรรมการแสดงทางเพศในเพศหญิง การแนะนำ GnRH ช่วยเพิ่มความต้องการสำหรับการมีเพศสัมพันธ์ (ประเภทของพิธีผสมพันธุ์) ใน Zonotrichia ที่มีหัวกริฟฟอน ในสัตว์เลี้ยงลูกด้วยนม การบริหาร GnRH ช่วยเพิ่มพฤติกรรมการแสดงทางเพศของตัวเมีย ดังที่เห็นในความหน่วงที่ลดลงของปากแม่น้ำหางยาว (Giant shrew) ในการแสดงส่วนท้ายของตัวผู้และเคลื่อนหางไปทางตัวผู้ ระดับ GnRH ที่เพิ่มขึ้นจะเพิ่มกิจกรรมของฮอร์โมนเพศชายในเพศชาย เกินกิจกรรมของระดับฮอร์โมนเพศชายตามธรรมชาติ การบริหาร GnRH ให้กับนกเพศผู้ทันทีหลังจากการเผชิญหน้าในดินแดนที่ก้าวร้าวส่งผลให้ระดับฮอร์โมนเทสโทสเตอโรนเพิ่มขึ้นเมื่อเทียบกับระดับที่สังเกตได้ตามธรรมชาติในระหว่างการเผชิญหน้าในอาณาเขตที่ก้าวร้าว ด้วยการเสื่อมสภาพของระบบ GnRH จะสังเกตเห็นผลกระทบที่หลีกเลี่ยงต่อสรีรวิทยาการสืบพันธุ์และพฤติกรรมของมารดา เมื่อเปรียบเทียบกับหนูเพศเมียที่มีระบบ GnRH ปกติ หนูเพศเมียที่มีจำนวนเซลล์ประสาทที่หลั่ง GnRH ลดลง 30% จะดูแลลูกหลานของพวกมันน้อยลง หนูเหล่านี้มีแนวโน้มที่จะปล่อยลูกหมาไว้ตามลำพังมากกว่าอยู่ด้วยกัน และจะใช้เวลานานกว่าในการหาลูกหมา
การประยุกต์ใช้ในสัตวแพทยศาสตร์
ฮอร์โมนธรรมชาติยังใช้ในสัตวแพทยศาสตร์เพื่อรักษาโรครังไข่เรื้อรังในโค อะนาล็อกสังเคราะห์ของ deslorelin ใช้ในการควบคุมการสืบพันธุ์ของสัตวแพทย์ด้วยรากฟันเทียมที่มีการปลดปล่อยอย่างต่อเนื่อง
:แท็ก
รายการวรรณกรรมที่ใช้:
Campbell RE, Gaidamaka G, Han SK, Herbison AE (มิ.ย. 2552) "การรวมกลุ่มเดนโดรเดนไดรต์และไซแนปส์ที่ใช้ร่วมกันระหว่างเซลล์ประสาทฮอร์โมนที่ปล่อย gonadotropin" การดำเนินการของ National Academy of Sciences ของสหรัฐอเมริกา 106 (26): 10835–40 ดอย:10.1073/pnas.0903463106. PMC 2705602 PMID 19541658
บราวน์ RM (1994). ความรู้เบื้องต้นเกี่ยวกับระบบประสาทวิทยา. เคมบริดจ์ สหราชอาณาจักร: สำนักพิมพ์มหาวิทยาลัยเคมบริดจ์ ไอเอสบีเอ็น 0-521-42665-0.
Ehlers K, Halvorson L (2013) "ฮอร์โมนปล่อย Gonadotropin (GnRH) และตัวรับ GnRH (GnRHR)" The Global Library of Women's Medicine. doi: 10.3843/GLOWM.10285. สืบค้นเมื่อ 5 พฤศจิกายน 2557.
Chorionic gonadotropin, Pregnil, Profazi, Gonakor, Horagonการจำแนกประเภท
ฮอร์โมน Gonadotropicกลไกการออกฤทธิ์
Gonadotropic, luteinizing. โต้ตอบกับตัวรับเมมเบรนเฉพาะของเซลล์อวัยวะสืบพันธุ์กระตุ้นระบบ adenylate cyclase และทำซ้ำผลของฮอร์โมน luteinizing ของต่อมใต้สมองส่วนหน้า ในผู้หญิงมันกระตุ้นและกระตุ้นการตกไข่, ส่งเสริมการแตกของรูขุมขนและการเปลี่ยนแปลงของมันเป็น corpus luteum, เพิ่มกิจกรรมการทำงานของ corpus luteum ในระยะ luteal ของรอบประจำเดือน, ยืดอายุการดำรงอยู่, ชะลอการเริ่มมีประจำเดือน ช่วยเพิ่มการผลิตโปรเจสเตอโรนและแอนโดรเจน ในกรณีของ corpus luteum ไม่เพียงพอ ส่งเสริมการฝังไข่และสนับสนุนการพัฒนาของรก การตกไข่มักจะทำได้ 32-36 ชั่วโมงหลังการให้ยา ในผู้ชายจะช่วยกระตุ้นการทำงานของเซลล์ Leydig ของลูกอัณฑะ ช่วยเพิ่มการสังเคราะห์และการผลิตฮอร์โมนเพศชาย ส่งเสริมการสร้างสเปิร์ม การพัฒนาลักษณะทางเพศทุติยภูมิและการสืบเชื้อสายของลูกอัณฑะในถุงอัณฑะ ดูดซึมเข้าสู่กระแสเลือดได้ดีเมื่อฉีดเข้ากล้าม ไม่มีผลต่อการกลายพันธุ์ เมื่อให้ยาแก่สตรีมีครรภ์ อาจส่งผลเสียต่อทารกในครรภ์ข้อบ่งชี้ในการนัดหมาย
ความผิดปกติของอวัยวะสืบพันธุ์ในความผิดปกติของ hypothalamic-pituitary: ในสตรี - ภาวะมีบุตรยากเนื่องจากความผิดปกติของต่อมใต้สมองและรังไข่
รวมทั้ง หลังจากการกระตุ้นเบื้องต้นของการเจริญเติบโตของรูขุมขนและการเพิ่มจำนวนเยื่อบุโพรงมดลูก
การละเมิด
รวมถึงการหายไป
รอบประจำเดือน,
เลือดออกผิดปกติของมดลูกในวัยเจริญพันธุ์,
ความไม่เพียงพอของการทำงานของ corpus luteum
การแท้งบุตรที่เป็นนิสัยและถูกคุกคามในช่วงไตรมาสแรกของการตั้งครรภ์
ควบคุม "superovulation" ระหว่างการผสมเทียม ในผู้ชาย - hypogonadotropic hypogonadism
ปรากฏการณ์ของขันที
hypogenitalism,
hypoplasia ลูกอัณฑะ,
กลุ่มอาการเกี่ยวกับอวัยวะสืบพันธุ์,
ความผิดปกติของการสร้างอสุจิ (oligospermia,
อะซูสเพอเมีย),
การเข้ารหัสลับ
ข้อห้าม
แพ้รวมถึง ไปยัง gonadotropins อื่น ๆ ต่อมใต้สมองยั่วยวนหรือเนื้องอกเนื้องอกที่ขึ้นอยู่กับฮอร์โมนหรือโรคอักเสบของอวัยวะสืบพันธุ์หัวใจและไตวายโรคหอบหืดโรคลมชักไมเกรน ในผู้หญิง - กลุ่มอาการกระตุ้นรังไข่มากเกินไปหรือการคุกคาม, เลือดออกผิดปกติของมดลูกที่ไม่ได้รับการวินิจฉัย, เนื้องอกในมดลูก, ซีสต์หรือการเจริญเติบโตมากเกินไปของรังไข่ไม่เกี่ยวข้องกับโรค polycystic, thrombophlebitis ในระยะเฉียบพลัน; ในผู้ชาย - มะเร็งต่อมลูกหมาก, วัยแรกรุ่นก่อนวัยอันควร (สำหรับการรักษา cryptorchidism) ข้อจำกัดสำหรับการใช้งาน: รังไข่ Polycystic (สำหรับการชักนำการตกไข่), เด็กอายุต่ำกว่า 4 ปี ใช้ระหว่างตั้งครรภ์และให้นมบุตร: ในระหว่างตั้งครรภ์ ควรพิจารณาถึงความเป็นไปได้ที่จะเกิดผลเสียต่อทารกในครรภ์กฎการรับเข้าเรียน
V / m ในขนาด 500-3000 IU / วัน ผู้ชาย - 2-3 ครั้งต่อสัปดาห์หลักสูตร 4 สัปดาห์ในช่วงเวลา 4-6 สัปดาห์ หลักสูตร 3-6 ดำเนินการเป็นเวลา 6-12 เดือน สำหรับผู้หญิงที่มีวัฏจักรการตกไข่เริ่มตั้งแต่วันที่ 10-12 ของรอบ 3000 IU 2-3 ครั้งโดยมีช่วงเวลา 2-3 วันหรือ 1500 IU 6-7 ครั้งทุกวัน ๆ กับแคระแกร็นต่อมใต้สมองที่มีปรากฏการณ์ของทารกทางเพศ - 500-1,000 IU 1-2 ครั้งต่อสัปดาห์เป็นเวลา 1-2 เดือนในหลักสูตรซ้ำ ด้วย cryptorchidism เด็กอายุต่ำกว่า 10 ปี - 500-1000 IU, 10-14 อายุปี - 1500 IU 2 สัปดาห์ละครั้งเป็นเวลา 4-6 สัปดาห์ในหลักสูตรซ้ำหรือต่อเนื่องเป็นเวลา 4-5 เดือนการควบคุมการวิเคราะห์
เมื่อใช้สำหรับการชักนำการตกไข่ แนะนำให้เลือกขนาดยาและการแก้ไขโดยขึ้นอยู่กับประสิทธิภาพ การวัดระดับเอสตราไดออลและโปรเจสเตอโรนในซีรัมเป็นประจำ อัลตราซาวนด์ของรังไข่ การตรวจวัดอุณหภูมิร่างกายพื้นฐานในแต่ละวัน และการปฏิบัติตามระบบการมีเพศสัมพันธ์ที่แพทย์แนะนำ . การพัฒนาของยั่วยวนหรือการก่อตัวของซีสต์รังไข่ต้องหยุดการรักษาชั่วคราว (เพื่อหลีกเลี่ยงการแตกของซีสต์) ละเว้นจากการมีเพศสัมพันธ์และการลดขนาดยาในหลักสูตรถัดไป ด้วยการเจริญเติบโตมากเกินไปของรังไข่อย่างมีนัยสำคัญหรือการเพิ่มขึ้นของความเข้มข้นของ estradiol ในซีรัมในเลือดในวันสุดท้ายของการรักษาด้วย menotropins หรือ urofollitropin การเหนี่ยวนำการตกไข่จะไม่ดำเนินการในรอบนี้ ในระหว่างการรักษาภาวะมีบุตรยากในผู้ชาย จำเป็นต้องวัดความเข้มข้นของฮอร์โมนเทสโทสเตอโรนในซีรัมในเลือดก่อนและหลังการให้ยา เพื่อกำหนดจำนวนและการเคลื่อนไหวของตัวอสุจิ ด้วยวัยแรกรุ่นก่อนวัยอันควรในระหว่างการรักษา cryptorchidism การบำบัดจะถูกยกเลิกและใช้วิธีการรักษาอื่น ๆ หากไม่มีการเปลี่ยนแปลงของการสืบเชื้อสายอัณฑะหลังจากให้ยา 10 โดส ไม่แนะนำให้รักษาต่อไป การวินิจฉัยภาวะ hypogonadism ในชายหนุ่มนั้นดำเนินการภายใต้การควบคุมความเข้มข้นของฮอร์โมนเทสโทสเตอโรนในเลือดก่อนการบริหารและหนึ่งวันหลังจากการรักษา (ด้วยการทำงานของอัณฑะปกติความเข้มข้นหลังการรักษาควรเพิ่มขึ้น 2 เท่า) ปริมาณหรือระยะเวลาในการบริหารที่เพิ่มขึ้นอย่างไม่สมเหตุสมผลอาจมาพร้อมกับการลดจำนวนอสุจิในการพุ่งออกมาในผู้ชายผลข้างเคียง
จากระบบประสาทและอวัยวะรับความรู้สึก: ปวดศีรษะ, หงุดหงิด, วิตกกังวล, อ่อนเพลีย, อ่อนแอ, ซึมเศร้า อาการแพ้: ผื่น (เช่นลมพิษ, แดง), angioedema, หายใจลำบาก อื่น ๆ : การก่อตัวของแอนติบอดี (เมื่อใช้เป็นเวลานาน), การขยายเต้านม, ความเจ็บปวดที่บริเวณที่ฉีด จากระบบสืบพันธุ์: ในผู้หญิง - ยั่วยวนของรังไข่, การก่อตัวของซีสต์รังไข่, กลุ่มอาการกระตุ้นรังไข่มากเกินไป, การตั้งครรภ์หลายครั้ง, อาการบวมน้ำที่ส่วนปลาย; ในผู้ชาย - วัยแรกรุ่นก่อนวัยอันควรการเพิ่มขึ้นของลูกอัณฑะในคลองขาหนีบทำให้ยากสำหรับพวกเขาที่จะลงมาต่อไปความเสื่อมของอวัยวะสืบพันธุ์การฝ่อของท่อ seminiferousลดการสังเคราะห์ (ยับยั้งการถอดรหัส) โปรแลคโตสแตติน (คือโดปามีน) กระตุ้นการหลั่งการระคายเคืองของหัวนมในระหว่างการให้นม, การตั้งครรภ์, ความถี่ในการมีเพศสัมพันธ์ที่เพิ่มขึ้น, ความเครียด, การนอนหลับ, เซโรโทนิน, เอสโตรเจน, แองจิโอเทนซิน
ลดการหลั่งไดไฮดรอกซีฟีนิลอะลานีน (DOPA)
กลไกการออกฤทธิ์
ไม่ทราบแน่ชัด มีหลักฐานว่ามีเปปไทด์ผู้ส่งสารตัวที่สอง M-1500 ซึ่งกระตุ้นการสังเคราะห์เคซีโนเจน
เป้าหมายและผลกระทบ
ในไตร่วมกับฮอร์โมนพาราไทรอยด์และฮอร์โมนการเจริญเติบโต ช่วยกระตุ้นไฮดรอกซิเลชันและกระตุ้นการทำงานของวิตามินดี
o กระตุ้นการเจริญเติบโตของต่อมน้ำนมและการหลั่งน้ำนมเมื่อมีฮอร์โมนเพศหญิง คอร์ติโคสเตียรอยด์และอินซูลินในระดับที่เพียงพอ
o ในระหว่างตั้งครรภ์สนับสนุนการทำงานของ corpus luteum และการหลั่งของฮอร์โมน o เพิ่มการสังเคราะห์ caseinogen RNA แลคโตสสังเคราะห์และ DNA
o มีส่วนในการรักษาสัญชาตญาณความเป็นแม่
o เพิ่มการสังเคราะห์ฮอร์โมนเทสโทสเตอโรนในเซลล์เลย์ดิก o กระตุ้นต่อมลูกหมากและการหลั่ง
o กระตุ้นการทำงานของ LH และ FSH ต่อการสร้างสเปิร์มและการทำงานของตัวอสุจิ
พยาธิวิทยา
Hypofunction
อาการของ Sheehan - ปัจจัยเสี่ยงคือการสูญเสียเลือดมากเกินไปในระหว่างการคลอดบุตรซึ่งนำไปสู่ปริมาณเลือดที่บกพร่องและเนื้อร้ายของต่อมใต้สมอง สัญญาณแรกคือการหยุดให้นมบุตรจากนั้นจะพบอาการอื่น ๆ ของภาวะ hypopituitarism
สาเหตุการทำงานมากเกินไปการสังเคราะห์ที่มากเกินไปเกิดขึ้นกับภาวะไทรอยด์ทำงานต่ำ การผลิตฮอร์โมน
เนื้องอก, ภาวะไตวายเรื้อรัง.
ภาพทางคลินิกเป็นผลให้ภาวะมีบุตรยากเกิดขึ้นในผู้ชายและผู้หญิงความอ่อนแอและ gynecomastia ในผู้ชาย amenorrhea และ galactorrhea ในผู้หญิง
ระดับฮอร์โมนที่เพิ่มขึ้นในระหว่างการให้นมหลังคลอดมีผลต่อการตกไข่เล็กน้อย ซึ่งอาจลดโอกาสของการตั้งครรภ์
G ฮอร์โมนโอนาโดโทรปิก
ซึ่งรวมถึงฮอร์โมนกระตุ้นรูขุมขน (FSH) และฮอร์โมน luteinizing (LH)
พวกเรา มนุษย์ choriogonin
โครงสร้าง
FSH และ LH เป็นไกลโคโปรตีนที่มีน้ำหนักโมเลกุล 30 kDa Choriogonin เป็นฮอร์โมนรกและยังเป็นไกลโคโปรตีนอีกด้วย ฮอร์โมนเหล่านี้ทั้งหมดคือ
ประกอบด้วยหน่วยย่อย α และ β หน่วยย่อย β ของฮอร์โมนแต่ละชนิดเป็นรายบุคคล ยูนิตย่อย α ของพวกมันเหมือนกันและคล้ายกับหน่วยย่อย α ของฮอร์โมนกระตุ้นต่อมไทรอยด์
สังเคราะห์
เกิดขึ้นใน gonadotrophs ของต่อมใต้สมอง
ระเบียบการสังเคราะห์และการหลั่ง
Gonadoliberin กระตุ้นการสังเคราะห์และการหลั่งในคลื่นด้วยวัฏจักรประมาณ 90"
ลดการสังเคราะห์เอ็นดอร์ฟินและฮอร์โมนเพศทางอ้อมผ่านการยับยั้งการสังเคราะห์กอนโดลิเบอริน ฮอร์โมนเพศจะกดการหลั่งของฮอร์โมนเหล่านี้โดยตรงขึ้นอยู่กับความเข้มข้น
กลไกการออกฤทธิ์
อะดีนิเลตไซโคลส
เป้าหมายและผลกระทบ
ในผู้ชาย ลูทีไนซิ่งฮอร์โมน
o ในเซลล์ Leydig เพิ่มการสังเคราะห์คอเลสเตอรอลและฮอร์โมนเพศชายเพิ่มเติม
ที่ ฮอร์โมนลูทีนซิ่งสำหรับผู้หญิง
o ใน corpus luteum เพิ่มการสังเคราะห์คอเลสเตอรอล โปรเจสเตอโรนและแอนโดรเจน
o เนื่องจากการเพิ่มขึ้นของความเข้มข้นที่ขึ้นกับ estradiol ทำให้เกิดการชักนำการตกไข่
พยาธิวิทยา
Hypofunction
ฮอร์โมนกระตุ้นรูขุมขน
o กระตุ้นการเจริญเติบโตของหลอดน้ำอสุจิ อัณฑะ กระตุ้นสเปิร์ม-
o ทำหน้าที่ในเซลล์ Sertoli ของอัณฑะและเพิ่มการสังเคราะห์โปรตีนที่จับกับแอนโดรเจนซึ่งช่วยให้จับจากเลือดและการขนส่งของฮอร์โมนเพศชายไปยังท่อกึ่งท่อและหลอดน้ำอสุจิ สิ่งนี้ช่วยให้คุณเพิ่มความเข้มข้นของฮอร์โมนเพศชายในที่นี้และกระตุ้นการสร้างสเปิร์ม
ฮอร์โมนกระตุ้นรูขุมขน
o กระตุ้นการเจริญเติบโตของรูขุมขนและเตรียมพร้อมสำหรับการทำงานของ LH
o ช่วยเพิ่มการแปลงแอนโดรเจนเป็นเอสโตรเจน
o วัยแรกรุ่นตอนปลายเกิดขึ้นในเด็ก
o ในผู้หญิง - oligomenorrhea, ขาดการตกไข่และภาวะมีบุตรยาก, ฝ่อของเต้านมและอวัยวะเพศ,
o ในผู้ชาย - ความอ่อนแอ, azoospermia, ลูกอัณฑะฝ่อ,
o ในทั้งสองเพศ - ความใคร่ลดลง ขนตามร่างกาย ผิวหนังบางลง และริ้วรอยเหี่ยวย่น
hyperfunction
การเพิ่มขึ้นของ FSH มักนำไปสู่การมีเลือดออกผิดปกติของมดลูก
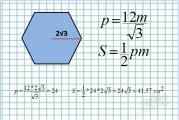
ฮอร์โมน gonadotropic สามชนิดถูกสกัดจากต่อมใต้สมองส่วนหน้า: กระตุ้นรูขุมขน (FSH), luteinizing (LH) และ luteotropic (LTH)
ฮอร์โมนทั้งสามมีผลต่อรังไข่ - การเจริญเติบโตและการพัฒนาของรูขุมขน การก่อตัวและการทำงานของ corpus luteum อย่างไรก็ตาม การเจริญเติบโตของรูขุมในระยะแรกสุดไม่ได้ขึ้นอยู่กับฮอร์โมน gonadotropic และเกิดขึ้นแม้หลังจากการผ่าตัดลดขนาดร่างกาย
FSH เกิดขึ้นจากเบโซฟิลกลมเล็ก ๆ ที่อยู่ในบริเวณรอบนอกของกลีบหน้า ฮอร์โมนนี้ทำหน้าที่ในระยะที่ไข่เป็นโอโอไซต์ขนาดใหญ่ที่ล้อมรอบด้วยแกรนูโลซาหลายชั้น FSH ทำให้เกิดการแพร่กระจายของเซลล์ granulosa และการหลั่งของ follicular fluid
LH เกิดจากเบสโซฟิลที่อยู่ตรงกลางของกลีบหน้า ในผู้หญิง ฮอร์โมนนี้ส่งเสริมการตกไข่และการเปลี่ยนแปลงของรูขุมขนเป็น corpus luteum ในผู้ชายเป็นฮอร์โมนที่กระตุ้นเซลล์คั่นระหว่างหน้า (GSIK)
ฮอร์โมนทั้งสองชนิด - FSH และ LH มีความคล้ายคลึงกันในโครงสร้างทางเคมีและคุณสมบัติทางเคมีกายภาพ พวกมันจะถูกหลั่งออกมาในระหว่างรอบเดือนและอัตราส่วนของพวกมันจะแตกต่างกันไปตามระยะของมัน ในการกระทำของพวกเขา FSH และ LH เป็นการทำงานร่วมกันและผลกระทบทางชีวภาพเกือบทั้งหมดเกิดขึ้นจากการหลั่งร่วมกัน
LTH หรือ prolactin ผลิตโดย acidophils ของต่อมใต้สมอง ฮอร์โมนนี้ทำหน้าที่ใน corpus luteum ซึ่งสนับสนุนการทำงานของต่อมไร้ท่อ หลังคลอดบุตรมีผลต่อการหลั่งน้ำนม ดังนั้นการทำงานของฮอร์โมนนี้จึงเกิดขึ้นหลังจากการกระตุ้นเบื้องต้นของอวัยวะเป้าหมายโดย FSH และ LH LTH ยับยั้งการหลั่งของ FSH ซึ่งสัมพันธ์กับการไม่มีประจำเดือนระหว่างให้นมลูก
ในระหว่างตั้งครรภ์ chorionic gonadotropin (CG) จะก่อตัวขึ้นในเนื้อเยื่อรก ซึ่งถึงแม้โครงสร้างจะแตกต่างจากฮอร์โมน gonadotropic ที่ต่อมใต้สมอง แต่ก็มีผลทางชีวภาพคล้ายกับ LH ซึ่งใช้ในการบำบัดด้วยฮอร์โมน
การกระทำทางชีวภาพของฮอร์โมน gonadotropic. ผลกระทบหลักของฮอร์โมน gonadotropic ในรังไข่คือทางอ้อมโดยการกระตุ้นการหลั่งของฮอร์โมนเนื่องจากวัฏจักรของต่อมใต้สมองและรังไข่ถูกสร้างขึ้นโดยมีลักษณะผันผวนในการผลิตฮอร์โมน
ระหว่างการทำงานของ gonadotropic ของต่อมใต้สมองกับการทำงานของรังไข่นั้น มีความสัมพันธ์ที่มีบทบาทสำคัญในการควบคุมรอบเดือน ฮอร์โมน gonadotropic จำนวนเล็กน้อยของต่อมใต้สมองมีผลกระตุ้นการผลิตฮอร์โมนของรังไข่ทำให้ความเข้มข้นของฮอร์โมนสเตียรอยด์ในเลือดเพิ่มขึ้น ในทางกลับกัน การเพิ่มขึ้นอย่างมีนัยสำคัญในเนื้อหาของฮอร์โมนรังไข่ยับยั้งการหลั่งของฮอร์โมนต่อมใต้สมองที่สอดคล้องกัน
ปฏิกิริยานี้ชัดเจนเป็นพิเศษระหว่าง FSH และ LH กับเอสโตรเจนและโปรเจสเตอโรนในอีกทางหนึ่ง การเจริญเติบโตและการพัฒนาของรูขุมขนรวมถึงการหลั่งของฮอร์โมนเอสโตรเจนนั้นถูกกระตุ้นโดย FSH แม้ว่าการมี LH ก็จำเป็นสำหรับการผลิตฮอร์โมนเอสโตรเจนอย่างเต็มรูปแบบเช่นกันการเพิ่มขึ้นอย่างมีนัยสำคัญในการตกไข่ของฮอร์โมนเอสโตรเจนจะยับยั้งการหลั่งของ FSH และกระตุ้น LH ภายใต้อิทธิพลของการพัฒนา corpus luteum กิจกรรมการหลั่งของหลังเพิ่มขึ้นด้วยการหลั่งของ LTH ส่งผลให้ฮอร์โมนโปรเจสเตอโรนไปยับยั้งการหลั่งของ LH และการหลั่ง FSH และ LH ที่ลดลงจะทำให้มีประจำเดือน การทำงานของวัฏจักรของต่อมใต้สมองและรังไข่นี้ถือเป็นวัฏจักรของต่อมใต้สมองและรังไข่ ซึ่งส่งผลให้เกิดการตกไข่และมีประจำเดือน
การหลั่งฮอร์โมน gonadotropic ไม่เพียงขึ้นอยู่กับระยะของวัฏจักรเท่านั้น แต่ยังขึ้นอยู่กับอายุด้วย ด้วยการหยุดการทำงานของรังไข่ในช่วงวัยหมดประจำเดือนกิจกรรม gonadotropic ของต่อมใต้สมองเพิ่มขึ้นมากกว่า 5 เท่าซึ่งสัมพันธ์กับการไม่มีผลยับยั้งฮอร์โมนสเตียรอยด์ ในกรณีนี้ การหลั่งของ FSH มีอิทธิพลเหนือกว่า
มีข้อมูลน้อยมากเกี่ยวกับการกระทำทางชีวภาพของ LTH เป็นที่เชื่อกันว่า LTH เร่งการเจริญเติบโตและการพัฒนาของต่อมน้ำนม กระตุ้นการหลั่งน้ำนมและกระบวนการสังเคราะห์ทางชีวภาพ รวมถึงการสังเคราะห์โปรตีนในต่อมน้ำนม
เมแทบอลิซึมของฮอร์โมน gonadotropic. การแลกเปลี่ยนฮอร์โมน gonadotropic ยังไม่ได้รับการศึกษาเพียงพอ พวกมันไหลเวียนอยู่ในเลือดเป็นเวลานานโดยกระจายไปในซีรัมต่างกัน: FSH จะเข้มข้นในเศษส่วนของ a1- และ b2-globulins และ LH จะเข้มข้นในเศษส่วนของอัลบูมินและ b1-globulins gonadotropins ทั้งหมดที่ผลิตในร่างกายจะถูกขับออกทางปัสสาวะ แม้จะมีความคล้ายคลึงกันของคุณสมบัติทางเคมีกายภาพของฮอร์โมน gonadotropic ที่แยกได้จากเลือดและปัสสาวะ แต่กิจกรรมทางชีววิทยาของ gonadotropins ในเลือดนั้นสูงกว่าปัสสาวะมาก อาจเป็นไปได้ว่าการหยุดทำงานของฮอร์โมนเกิดขึ้นในตับแม้ว่าจะไม่มีหลักฐานโดยตรงเกี่ยวกับเรื่องนี้
กลไกการออกฤทธิ์ของฮอร์โมน. การศึกษากลไกการออกฤทธิ์ของฮอร์โมนเป็นที่สนใจอย่างมาก เนื่องจากเป็นที่ทราบกันดีว่าอิทธิพลของฮอร์โมนที่มีต่อการเผาผลาญอาหารในหลาย ๆ ด้านเป็นที่ทราบกันดี ความหลากหลายในการทำงานของฮอร์โมน โดยเฉพาะชุดสเตียรอยด์ในร่างกายนี้ เป็นไปได้อย่างเห็นได้ชัดเมื่อมีกลไกทั่วไปของการกระทำของพวกมันในเซลล์
ผลการศึกษาทดลองกับฮอร์โมน 3H และ 125I ที่ติดฉลากแสดงให้เห็นว่าในเซลล์ของอวัยวะเป้าหมายมีกลไก "การรับรู้" ของฮอร์โมนเนื่องจากฮอร์โมนสะสมในเซลล์ใดเซลล์หนึ่ง ปัจจุบันสามารถพิสูจน์ได้ว่าผลของฮอร์โมนต่อเซลล์นั้นสัมพันธ์กับตัวรับโปรตีนที่มีความจำเพาะสูง การรับฮอร์โมนมีสองประเภท - สำหรับฮอร์โมนสเตียรอยด์ซึ่งเจาะเข้าไปในเซลล์ค่อนข้างง่าย (การรับภายในเซลล์) และสำหรับฮอร์โมนโปรตีนซึ่งแทบไม่แทรกซึมเข้าไปในเซลล์ (การรับเมมเบรน) ในกรณีแรกอุปกรณ์รับจะอยู่ในไซโตพลาสซึมของเซลล์และกำหนดการกระทำของฮอร์โมนเอง ในกรณีที่สองจะทำให้เกิดการก่อตัวของตัวกลาง ฮอร์โมนแต่ละตัวจับกับตัวรับเฉพาะของมัน โปรตีนตัวรับจะถูกแปลเป็นภาษาท้องถิ่นอย่างเด่นชัดในอวัยวะเป้าหมายสำหรับฮอร์โมนนี้ แต่การทำงานของฮอร์โมนในวงกว้าง โดยเฉพาะฮอร์โมนสเตียรอยด์ บ่งชี้ว่ามีตัวรับอยู่ในอวัยวะอื่น
ขั้นตอนแรกในการทำงานของฮอร์โมนในเซลล์คือการผูกมัดกับโปรตีนและการก่อตัวของคอมเพล็กซ์ตัวรับฮอร์โมน กระบวนการนี้สามารถย้อนกลับได้และเกิดขึ้นได้โดยไม่ต้องมีส่วนร่วมของเอนไซม์ ตัวรับมีความสามารถในการจับกับฮอร์โมนที่จำกัด ซึ่งป้องกันไม่ให้เซลล์แทรกซึมสารออกฤทธิ์ทางชีวภาพที่มากเกินไป
จุดสำคัญของการกระทำของฮอร์โมนสเตียรอยด์คือนิวเคลียสของเซลล์ แผนผังสามารถจินตนาการได้ว่าคอมเพล็กซ์ตัวรับฮอร์โมนที่เกิดขึ้นหลังจากการเปลี่ยนแปลงบางอย่างแทรกซึมเข้าไปในนิวเคลียสอันเป็นผลมาจากการสังเคราะห์ RNA ผู้ส่งสารเฉพาะโปรตีนเอนไซม์เฉพาะจะถูกสังเคราะห์บนเมทริกซ์ในไซโตพลาสซึมของเซลล์ หน้าที่ซึ่งรับรองการทำงานของฮอร์โมน
การกระทำของฮอร์โมนเปปไทด์ซึ่งรวมถึง gonadotropins เริ่มต้นด้วยอิทธิพลที่มีต่อระบบ adenylcyclase "สร้างขึ้นใน" เยื่อหุ้มเซลล์ ฮอร์โมนต่อมใต้สมองที่ทำหน้าที่ในเซลล์ กระตุ้นเอนไซม์ที่แปลเป็นภาษาท้องถิ่นในเยื่อหุ้มเซลล์ (adenyl cyclase) ที่เกี่ยวข้องกับตัวรับเฉพาะสำหรับฮอร์โมนแต่ละตัว เอนไซม์นี้ส่งเสริมการก่อตัวของไซคลิก 31,5!-อะดีโนซีนโมโนฟอสเฟต (cAMP) จาก ATP ในไซโตพลาสซึมที่ผิวเยื่อหุ้มชั้นใน แคมป์ที่เกิดขึ้นในเชิงซ้อนกับรีเซพเตอร์ ซึ่งเป็นหน่วยย่อยของไคเนสโปรตีนที่ขึ้นกับแคมป์ กระตุ้นฟอสโฟรีเลชันของเอ็นไซม์จำนวนหนึ่ง (ฟอสโฟรีเลส บี ไคเนส ไลเปส บี) และโปรตีนอื่นๆ โปรตีนฟอสโฟรีเลชั่นช่วยกระตุ้นการสลายตัวของไกลโคเจนและการสังเคราะห์โปรตีนในโพลีโซมไอที ง.
ดังนั้นกลไกการออกฤทธิ์ของฮอร์โมน gonadotropic จึงรวมถึงโปรตีนตัวรับสองประเภท: ตัวรับฮอร์โมนเมมเบรนและตัวรับแคมป์ ดังนั้น แคมป์จึงกลายเป็นเหมือนที่เคยเป็นมา ตัวกลางภายในเซลล์ที่รับรองการถ่ายโอนผลของฮอร์โมนต่อระบบเอนไซม์
ฮอร์โมนของมนุษย์เป็นสารอินทรีย์ที่มีโครงสร้างต่างๆ ตามความสำคัญทางสรีรวิทยา พวกเขาแบ่งออกเป็นสองกลุ่ม: ที่เรียกว่าฮอร์โมนเริ่มต้นที่กระตุ้นการทำงานของต่อมไร้ท่อ (ฮอร์โมนของมลรัฐและต่อมใต้สมอง) และฮอร์โมน-นักแสดงที่ส่งผลโดยตรงต่อการทำงานบางอย่างของร่างกาย
ฮอร์โมน Gonadotropic ของต่อมใต้สมอง
พวกเขากระตุ้นการทำงานของรังไข่ มีการระบุฮอร์โมนสามชนิดดังกล่าว: การกระตุ้นรูขุมขน (FSH) ซึ่งส่งเสริมการพัฒนาของรูขุมขนรังไข่ luteinizing (LH) ทำให้เกิด luteinization ของรูขุมขน luteotropic (LTH) สนับสนุนการทำงานของ corpus luteum ในระหว่างรอบเดือนและมีผล lactotropic
FSH และ LH มีความคล้ายคลึงกันในโครงสร้างทางเคมี (ทั้งสองเป็นไกลโคโปรตีน) เช่นเดียวกับคุณสมบัติทางเคมีกายภาพ ทำให้ยากที่จะแยกพวกมันออกจากต่อมใต้สมองในรูปแบบที่บริสุทธิ์ อย่างไรก็ตาม ความคล้ายคลึงกันทางโครงสร้างของ FSH และ LH นั้นมีบทบาทพิเศษอย่างเห็นได้ชัด เนื่องจากการควบคุมการทำงานของรังไข่นั้นดำเนินการภายใต้การกระทำร่วมกันของฮอร์โมนเหล่านี้
FSH (น้ำหนักโมเลกุลสัมพัทธ์ 30,000) ก่อตัวเป็นเบโซฟิลทรงกลมขนาดเล็กที่อยู่บริเวณรอบนอกของต่อมใต้สมองส่วนหน้า นิวเคลียสของเซลล์เหล่านี้มีรูปร่างผิดปกติและไซโตพลาสซึมมีไกลโคโปรตีนแกรนูลขนาดใหญ่จำนวนมาก
LH (น้ำหนักโมเลกุลสัมพัทธ์ 30,000) ก่อตัวเป็นเบสโซฟิลที่อยู่ตรงกลางของกลีบหน้า นิวเคลียสของพวกมันมีรูปร่างผิดปกติเช่นกันไซโตพลาสซึมมีเม็ดเบสหลายชนิด โมเลกุล FSH และ LH มีส่วนประกอบของคาร์โบไฮเดรต ซึ่งรวมถึงเฮกโซส ฟรุกโตส เฮกโซซามีน และกรดเซียลิก
กิจกรรมทางสรีรวิทยาของฮอร์โมนทั้งสองนั้นพิจารณาจากการมีพันธะซัลไฟด์และมีซิสทีนและซิสเทอีนในปริมาณสูง
เนื่องจาก FSH และ LH เป็นสารเสริมฤทธิ์กันและผลกระทบทางชีวภาพเกือบทั้งหมดจากการกระทำของพวกเขา - การพัฒนาของรูขุมขน, การตกไข่, การหลั่งของฮอร์โมนเพศ - เกิดขึ้นพร้อมกับการปลดปล่อยร่วมกัน การพิจารณาผลกระทบที่ซับซ้อนต่ออวัยวะและระบบต่างๆ
จากข้อมูลปัจจุบัน การเตรียม FSH ที่มีความบริสุทธิ์สูงไม่ได้กระตุ้นการพัฒนาของรูขุมขนในรังไข่ ในขณะที่ส่วนผสมของ LH เพียงเล็กน้อยจะทำให้พวกมันเติบโตและโตเต็มที่ Callantie (1965) สามารถแสดงให้เห็นว่าผลกระทบจำเพาะของ FSH ต่อรังไข่คือการกระตุ้นการสังเคราะห์ DNA ในนิวเคลียสของเซลล์ฟอลลิคูลาร์ การศึกษาล่าสุดแสดงให้เห็นว่าสิ่งนี้ต้องการการกระทำของเอสโตรเจนพร้อมกัน (Mangoe et al., 1972; Reter et al., 1972)
เป็นที่ทราบกันดีว่า Gonadotropins ช่วยเพิ่มน้ำหนักรังไข่และด้วยเหตุนี้การสังเคราะห์โปรตีน ช่วยเพิ่มการทำงานของเอนไซม์หลายชนิดที่เกี่ยวข้องกับการเผาผลาญโปรตีนและคาร์โบไฮเดรต
ความเข้มข้นของ FSH และ LH ในต่อมใต้สมองจะค่อยๆ เพิ่มขึ้นเมื่อเข้าสู่วัยเจริญพันธุ์ กิจกรรมทางชีวภาพของฮอร์โมน gonadotropic ในคนทุกวัยไม่เหมือนกัน ดังนั้น FSH ที่แยกได้จากปัสสาวะของเด็กผู้หญิงจึงมีความกระตือรือร้นมากกว่าที่แยกได้จากปัสสาวะของสตรีวัยผู้ใหญ่และสตรีที่เคยมีประสบการณ์
ในระหว่างตั้งครรภ์ ฮอร์โมน gonadotropic อีกตัวหนึ่งจะก่อตัวขึ้นในรก - chorionic gonadotropin (CG) มีผลทางชีวภาพคล้ายกับฮอร์โมน gonadotropic ของต่อมใต้สมอง การหลั่งของ gonadotropins โดยต่อมใต้สมองในระหว่างตั้งครรภ์จะลดลง
นอกจากผลกระทบเฉพาะต่อรังไข่แล้ว ฮอร์โมน gonadotropic ยังมีผลต่อกระบวนการต่างๆ ในร่างกายอย่างชัดเจน พบว่าทั้ง CG และ LH เพิ่มกิจกรรมละลายลิ่มเลือดของเลือด (Ch. S. Guseynov et al., 1967) การปรากฏตัวของ gonadotropins ในการเตรียมอัลบูมินที่ผลิตขึ้นทำให้การใช้ในคลินิกมีประสิทธิภาพในการรักษาโรคภูมิแพ้และโรคที่มีส่วนประกอบทางภูมิคุ้มกัน
ด้วยการแนะนำของฮอร์โมน gonadotropic ความตื่นเต้นง่ายของส่วนต่าง ๆ ของระบบประสาทจะเปลี่ยนไป พวกเขามีผลในเชิงบวกและเร่งการรักษาแผลในกระเพาะอาหารในสัตว์ทดลอง
LTG (น้ำหนักโมเลกุลสัมพัทธ์ 24,000-26,000) ถูกสร้างโดยแอซิโดฟิลที่ต่อมใต้สมอง ไซโตพลาสซึมของเซลล์เหล่านี้มีเมล็ดธัญพืชจำนวนมากที่ย้อมด้วยสีแดงด้วยสีแดงเลือดนก
ตามโครงสร้างทางเคมี LTG เป็นโปรตีนอย่างง่าย ผลกระทบทางชีวภาพหลักของมันคือการกระตุ้นการสร้างน้ำนมในระหว่างการให้นมในสัตว์บางชนิดและในมนุษย์ นอกจากนี้ฮอร์โมนยังสนับสนุนการทำงานของต่อมไร้ท่อของ corpus luteum
แอนติโกนาโดโทรปินส์
ด้วยการนำฮอร์โมน gonadotropic ที่แยกได้จากซีรัมหรือต่อมใต้สมองของสัตว์เข้าสู่ร่างกายมนุษย์ แอนติบอดี antigonadotropic จำเพาะจะปรากฏในเลือด พวกเขาต่อต้านผลกระทบของฮอร์โมนที่ฉีดเข้าไป
การศึกษาโดย Stevens and Crystle (1973) แสดงให้เห็นว่าแม้จะมีการแนะนำของ chorionic gonadotropin ของมนุษย์ แอนติบอดีก็ก่อตัวขึ้นในร่างกายที่ทำปฏิกิริยากับ LH เห็นได้ชัดว่านี่เป็นเพราะความใกล้ชิดของโครงสร้างทางเคมีของ CG และ LG ในการเตรียมการที่ทำให้บริสุทธิ์ไม่เพียงพอที่แยกได้จากปัสสาวะหรือเนื้อเยื่อต่อมใต้สมอง อาจมี antigonadotropins (O. N. Savchenko, 1967) ยังไม่ได้อธิบายลักษณะของสารเหล่านี้ เป็นที่ทราบกันว่าไม่เหมือนกับฮอร์โมน gonadotropic ที่มีความเสถียรทางความร้อน
ฮอร์โมนเพศ
ฮอร์โมนที่เรียกว่าการออกฤทธิ์ซึ่งส่งผลต่ออวัยวะเพศและทั่วร่างกาย ได้แก่ ฮอร์โมนเพศกลุ่มหนึ่ง (“ฮอร์โมนการสืบพันธุ์”) พวกมันถูกสร้างขึ้นในรังไข่ในปริมาณที่น้อยกว่า - ในเยื่อหุ้มสมองต่อมหมวกไต ในระหว่างตั้งครรภ์ รกเป็นแหล่งของฮอร์โมนเพศ
ตามการกระทำและสถานที่ของการก่อตัวของพวกเขาจะแบ่งออกเป็น: เอสโตรเจนซึ่งทำให้เกิดการเป็นสัด (เป็นสัด) หรือเคราติไนเซชันของเยื่อบุผิวในช่องคลอดในสัตว์; gestagens หรือฮอร์โมน corpus luteum ซึ่งเป็นคุณสมบัติทางสรีรวิทยาหลักคือการกระตุ้นกระบวนการที่รับประกันการฝังของไข่ที่กำลังพัฒนาและการพัฒนาของการตั้งครรภ์ แอนโดรเจนหรือฮอร์โมนเพศชายที่มีผล virilizing
นอกจากสารเหล่านี้แล้ว รังไข่ยังผลิตฮอร์โมนอีกชนิดหนึ่ง - รีแล็กติน ซึ่งทำให้เอ็นของข้อต่อหัวหน่าวคลายตัวระหว่างการคลอดบุตร เช่นเดียวกับการอ่อนตัวของปากมดลูกและการขยายตัวของคลองปากมดลูก อย่างไรก็ตาม บทบาทของฮอร์โมนนี้ในร่างกายยังไม่เป็นที่เข้าใจกันดีนัก
เอสโตรเจนและเจสทาเจนเป็นฮอร์โมนเพศหญิง พวกมันมีผลเฉพาะกับอุปกรณ์การสืบพันธุ์เป็นหลัก เช่นเดียวกับต่อมน้ำนม อวัยวะที่ไวต่อการทำงานของฮอร์โมนมากที่สุดเรียกว่าอวัยวะเป้าหมาย สำหรับฮอร์โมนเพศ เป้าหมายคือ มดลูก ช่องคลอด ท่อนำไข่ และรังไข่ ตามโครงสร้างทางเคมี ฮอร์โมนเพศทั้งหมด ยกเว้นการผ่อนคลาย คือสเตียรอยด์ สารเหล่านี้เป็นสารที่มีโครงสร้างของไซโคลเพนเทนฟีแนนทรีนและสร้างขึ้นตามแบบแผนทั่วไป วงแหวนที่ประกอบเป็นโครงกระดูกของสเตียรอยด์มักจะเขียนแทนด้วยตัวอักษร A, B, C และ D
ลำดับเลขของอะตอมคาร์บอนในชุดของสารประกอบสเตียรอยด์ได้พัฒนาขึ้นในอดีตในระหว่างการศึกษา อะตอมของคาร์บอนของวงแหวน A, B และ D ถูกนับตามทิศทางตามเข็มนาฬิกา อะตอมของวงแหวน C จะอยู่ในทิศทางของมัน
เอสโตรเจน

เหล่านี้เป็นฮอร์โมนเพศหญิงที่สำคัญที่สุด ส่วนใหญ่เกิดขึ้นในรังไข่ - ในเซลล์คั่นระหว่างหน้าและเยื่อหุ้มชั้นในของรูขุมขน ในสตรีที่ไม่ได้ตั้งครรภ์ จะมีการสร้างเอสโตรเจนจำนวนหนึ่งขึ้นในเยื่อหุ้มสมองต่อมหมวกไต
เอสโตรเจนหลัก ได้แก่ เอสตราไดออล เอสโตรน และเอสตริออล นอกจากนี้ ฮอร์โมนเอสโตรเจนอื่นๆ จำนวนหนึ่งถูกแยกออกจากของเหลวทางชีวภาพของร่างกายมนุษย์ ซึ่งถือเป็นผลิตภัณฑ์เมตาบอลิซึมของเอสโตรเจนหลักสามชนิด
คุณสมบัติทั่วไปของสารเหล่านี้คือความสามารถในการทำให้เกิดการเป็นสัดในสัตว์ ดังนั้นเมื่อทำการประเมินกิจกรรมของฮอร์โมนเฉพาะจะพิจารณาถึงปริมาณขั้นต่ำที่ทำให้เกิดการเป็นสัด
เพื่อตรวจสอบกิจกรรมของฮอร์โมนเพศหญิงใช้วิธี Allen และ Doisy ประกอบด้วยการให้สารสกัดจากรังไข่หรือสารฮอร์โมนที่ศึกษาในปริมาณต่างๆ แก่สัตว์ตอน (หนูหรือหนู) ซึ่งทำให้พวกมันเป็นสัด ไม้กวาดที่ถ่ายในระหว่างการเป็นสัดมีเซลล์เคราติไนซ์จำนวนมาก ปริมาณสารที่น้อยที่สุด เมื่อให้ยาซึ่งสามารถตรวจพบเซลล์เคราตินได้ใน 70% ของหนูทดลองตอนทดลอง เรียกว่าหน่วยเมาส์
ตามข้อตกลงระหว่างประเทศที่บรรลุในปี 2482 เอสโตรนผลึกถือเป็นยามาตรฐาน
I. N. Nazarov และ L. D. Bergelson (1955) แนะนำฮอร์โมนเอสโตรเจนใต้ผิวหนังให้กับหนูทดลอง โดยพิจารณาแล้วว่าขนาดยาเอสโตรนที่เล็กที่สุดที่ออกฤทธิ์คือ 0.7 ไมโครกรัม เอสตราไดโอ-ลา-176 คือ 0.1 และเอสตริออลคือ 10 ไมโครกรัม ดังนั้น จากการทดสอบของ Allen และ Doisy เอสโตรเจนที่ออกฤทธิ์มากที่สุดคือเอสตราไดออล และเอสตริออลที่ออกฤทธิ์น้อยที่สุด
กิจกรรมของฮอร์โมนส่วนใหญ่ขึ้นอยู่กับวิธีการบริหาร ดังนั้น estriol เมื่อฉีดเข้าใต้ผิวหนังจะอ่อนแอลง และเมื่อให้ทางปาก - แรงกว่า estrone
กิจกรรมทางชีวภาพของเอสโตรเจนหลักสามตัวนั้นแตกต่างกัน และแต่ละตัวมีผลต่างกันต่ออวัยวะเป้าหมาย - มดลูกและช่องคลอด ดังนั้น หาก estradiol มีความกระตือรือร้นมากกว่า estriol และ estrone ตามการทดสอบของ Allen และ Doisy แล้ว estriol กลับกลายเป็นว่ามีฤทธิ์มากที่สุดตามการทดสอบอื่น: การเพิ่มน้ำหนักของมดลูกของหนูที่ยังไม่บรรลุนิติภาวะ ดังนั้นเยื่อบุโพรงมดลูกจึงไวต่อ estradiol มากที่สุดและกล้ามเนื้อมดลูกมีความไวต่อ estriol มากที่สุด estriol ปริมาณเล็กน้อยมีผลอย่างมากต่อเนื้อเยื่อของช่องคลอดและคลองปากมดลูก ด้วยการแนะนำเข้าสู่เยื่อบุผิวของอวัยวะเหล่านี้ mucopolysaccharides ที่เป็นกลางจะเกิดขึ้นอย่างเข้มข้นกว่าภายใต้การกระทำของ estrone และ estradiol เยื่อบุโพรงมดลูกตอบสนองต่อ estriol ในปริมาณมากเท่านั้น
ปัจจุบันมีการสังเคราะห์ยามากกว่า 100 ชนิดที่มีคุณสมบัติเอสโตรเจนเด่นชัด แต่ไม่มีโครงสร้างสเตียรอยด์ กิจกรรมของเอสโตรเจนของสารเหล่านี้สูงกว่าฮอร์โมนสเตียรอยด์ นอกจากนี้ การกระทำของเอสโตรเจนยังเหมือนกันทั้งเมื่อให้ทางปากและทางหลอดเลือด
คุณสมบัติทางชีวภาพหลักของเอสโตรเจนทั้งหมด ทั้งโครงสร้างสเตียรอยด์และไม่ใช่สเตียรอยด์ คือความสามารถในการมีผลเฉพาะต่ออวัยวะสืบพันธุ์สตรีและกระตุ้นการพัฒนาลักษณะทางเพศทุติยภูมิ
เอสโตรเจนทำให้เกิดยั่วยวนและ hyperplasia ของเยื่อบุโพรงมดลูกและ myometrium แม้แต่การฉีดฮอร์โมนเหล่านี้เพียงครั้งเดียวก็ส่งผลต่อหลอดเลือดในมดลูก กระตุ้นการหลั่งของฮีสตามีนและเซโรโทนิน ซึ่งเพิ่มการซึมผ่านของเส้นเลือดฝอยในมดลูก ซึ่งนำไปสู่การกักเก็บโซเดียมและน้ำในเนื้อเยื่อ เยื่อบุผิวทรงกระบอกของปากมดลูกภายใต้อิทธิพลของเอสโตรเจนกลายเป็นหลายชั้นเยื่อบุผิวของต่อมท่อเริ่มหลั่งเมือกที่มีความหนืดต่ำซึ่งเป็นผลมาจากการที่การหลั่งฮอร์โมนเอสโตรเจนเพิ่มขึ้น โพรงมดลูกจะอำนวยความสะดวก
ภายใต้อิทธิพลของเอสโตรเจนเยื่อบุผิวของช่องคลอดก็มีการเปลี่ยนแปลงลักษณะเช่นกัน ชั้นของเซลล์หนาขึ้นและไกลโคเจนจะสะสมอยู่ในนั้นซึ่งก่อให้เกิดการสืบพันธุ์ของไม้เดเดอร์เลน
เอสโตรเจนมีส่วนช่วยในการพัฒนาระบบขับถ่ายของต่อมน้ำนมเช่นเดียวกับการเจริญเติบโตมากเกินไปของสโตรมาของต่อม สิ่งที่น่าสนใจอย่างยิ่งคือคำถามเกี่ยวกับผลของเอสโตรเจนต่อการเกิดมะเร็งเต้านม แม้ว่าการทดลองในสัตว์ทดลองไม่ได้แสดงให้เห็นถึงการพึ่งพาการพัฒนาของมะเร็งอย่างเข้มงวดกับปริมาณของฮอร์โมนเอสโตรเจนที่ได้รับ แต่ความสัมพันธ์ระหว่างการเพิ่มขึ้นของเนื้อหาของเอสโตรเจน (ความคงอยู่ของรูขุมขน เนื้องอกในรังไข่ ฯลฯ) ได้รับการพิสูจน์ด้วยการพัฒนาของ โรคเต้านมอักเสบเรื้อรัง การเพิ่มขึ้นของกิจกรรมไมโทติคของเยื่อบุผิวของต่อมน้ำนมภายใต้อิทธิพลของเอสโตรเจนได้รับการพิสูจน์อย่างน่าเชื่อถือ (S. S. Laguchev, 1970)
การแนะนำของฮอร์โมนเอสโตรเจนในปริมาณมากเช่นเดียวกับฮอร์โมนอื่น ๆ ที่ผลิตโดยต่อมไร้ท่อส่วนปลายช่วยยับยั้งการหลั่งฮอร์โมนกระตุ้นของต่อมใต้สมองและมลรัฐซึ่งเกี่ยวข้องโดยตรงกับการผลิตฮอร์โมนเอสโตรเจน - FSH และ LH
ฮอร์โมนเอสโตรเจนไม่เพียงส่งผลกระทบต่ออวัยวะเป้าหมายเท่านั้น แต่ยังส่งผลต่อทั้งร่างกายด้วย สิ่งนี้จะต้องนำมาพิจารณาเมื่อกำหนดการรักษาด้วยฮอร์โมน
ภายใต้อิทธิพลของเอสโตรเจน โซเดียม น้ำ และไนโตรเจนจะคงอยู่ในร่างกาย ซึ่งมักจะช่วยลดการขับปัสสาวะ
อิทธิพลของเอสโตรเจนต่อการเผาผลาญไขมันแสดงให้เห็นอย่างชัดเจน มีความสัมพันธ์ระหว่างการทำงานของรังไข่กับการเกิดหลอดเลือด เมื่อนำรังไข่ออกทั้งในคลินิกและในการทดลองพบว่ามีปริมาณคอเลสเตอรอลในเลือดเพิ่มขึ้น ดังนั้นเอสโตรเจนจึงถูกใช้ในการรักษาหลอดเลือด
ปริมาณเอสโตรเจนทางสรีรวิทยากระตุ้นการทำงานของระบบ reticuloendothelial เพิ่มการผลิตแอนติบอดีและกิจกรรมของ phagocytes ส่งผลให้ร่างกายมีภูมิต้านทานการติดเชื้อเพิ่มขึ้น
หลังจากฉีดเอสโตรเจนเพียงครั้งเดียว หลอดเลือดสมองจะขยายตัว ซึ่งอาจเกิดจากการหลั่งของอะเซทิลโคลีน นอกจากนี้ยังพบว่า (Goodrich, Wood, 1966) ที่ estradiol ช่วยเพิ่มความยืดหยุ่นของเส้นเลือดส่วนปลาย สิ่งนี้นำไปสู่อัตราการไหลเวียนของเลือดลดลง ในทางกลับกันการบริหารเอสโตรเจนเป็นเวลานานจะเพิ่มความดันโลหิต เอสโตรเจนมีผลบางอย่างต่อการสร้างเม็ดเลือด สิ่งนี้อธิบายจำนวนเซลล์เม็ดเลือดแดงในเพศหญิงต่ำกว่าในเพศชาย (S. I. Ryabov, 1963)
เอสโตรเจนในระดับหนึ่งจะกำหนดส่วนสูงและน้ำหนักของร่างกาย สมมติว่าเอสโตรเจนมีบทบาทสำคัญในการควบคุมการแบ่งเซลล์ อย่างไรก็ตาม ข้อมูลในประเด็นนี้ขัดแย้งกัน เป็นที่ทราบกันดีว่าเมื่อมีการใช้เอสโตรเจนในปริมาณมากจุดโฟกัสของการแพร่กระจายจะปรากฏในร่างกายซึ่งบางครั้งก็ได้รับลักษณะบลาสโตมาตัส ในทางกลับกัน มีข้อมูลเกี่ยวกับผลการยับยั้งของเอสโตรเจนต่อการเจริญเติบโตของเนื้องอก โดยเฉพาะอย่างยิ่ง เกี่ยวกับการเติบโตของเนื้องอกต่อมลูกหมาก เฮิรตซ์ (1967) ในการทบทวนเนื้อหาเกี่ยวกับบทบาทของฮอร์โมนสเตียรอยด์ในสาเหตุและการเกิดโรคของมะเร็ง สรุปได้ว่าการศึกษาทางคลินิกไม่สามารถพิสูจน์ความสามารถของเอสโตรเจนในการทำให้เกิดเนื้องอกได้
เอสโตรเจนส่งผลกระทบต่ออวัยวะต่อมไร้ท่อเกือบทั้งหมด ผลกระทบส่วนใหญ่ขึ้นอยู่กับปริมาณ ดังนั้น ปริมาณขนาดเล็กและขนาดกลางจะกระตุ้นการพัฒนาของรังไข่และการเจริญเติบโตของรูขุม ขนาดใหญ่ยับยั้งการตกไข่และนำไปสู่การคงอยู่ของรูขุมขน และปริมาณมากทำให้เกิดกระบวนการฝ่อในรังไข่ (V. E. Liivrand, V. A. Kask, 1973) เอสโตรเจนมีอิทธิพลอย่างมากต่อต่อมใต้สมองส่วนหน้า (adenohypophysis) ปริมาณเล็กน้อยกระตุ้นการสร้างฮอร์โมนในต่อมในขณะที่ปริมาณมากยับยั้งการทำงานของมัน ฮอร์โมนเอสโตรเจนขัดขวางการก่อตัวของฮอร์โมนการเจริญเติบโต สถานการณ์นี้ควรคำนึงถึงเมื่อกำหนดให้ยาเอสโตรเจนแก่ผู้ป่วยในวัยเจริญพันธุ์และก่อนวัยอันควร
ผลของเอสโตรเจนยังส่งผลต่อการทำงานของต่อมไทรอยด์ แม้ว่าข้อมูลเกี่ยวกับธรรมชาติของผลกระทบนี้จะขัดแย้งกัน แต่ผู้เขียนส่วนใหญ่สังเกตเห็นผลกระตุ้นของฮอร์โมนในปริมาณน้อยและผลการบล็อกของปริมาณมาก (N.K. Gridneva, N.G. Dorosheva, 1973)
เอสโตรเจนกระตุ้นต่อมหมวกไต: ภายใต้อิทธิพลของพวกมัน มวลของต่อมหมวกไตจะเพิ่มขึ้นหลังการตัดอัณฑะ และเนื้อหาของคอร์ติโคสเตียรอยด์ในเลือดเพิ่มขึ้น ภายใต้อิทธิพลของเอสโตรเจนจะเกิดการฝ่อของต่อมไทมัส
แม้ว่าผลของเอสโตรเจนที่ผลิตโดยรังไข่และเอสโตรเจนที่ไม่ใช่สเตียรอยด์ต่ออวัยวะเป้าหมายและร่างกายทั้งสองจะคล้ายคลึงกัน แต่ก็มีความแตกต่างบางประการที่ควรพิจารณาเมื่อเลือกการรักษาด้วยฮอร์โมนที่มีเหตุผล ดังนั้นยาสเตียรอยด์จึงมีผลรุนแรงกว่าและมีผลข้างเคียงน้อยกว่า เห็นได้ชัดว่านี่เป็นเพราะความจริงที่ว่าเอสโตรเจนตามธรรมชาติถูกขับออกจากร่างกายได้เร็วกว่าและถูกปิดการใช้งานในตับ นอกจากนี้ เอสโตรเจนที่ไม่ใช่สเตียรอยด์มีผลเด่นชัดมากขึ้นต่อเซลล์ตับ ดังนั้นหากการทำงานของมันบกพร่อง ควรจำกัดการใช้
แอนติเอสโตรเจน. มีสารหลายชนิดที่การกระทำกับอวัยวะเพศนั้นตรงกันข้ามกับการกระทำของเอสโตรเจนนั่นคือพวกมันเป็นปฏิปักษ์ สารเหล่านี้สามารถแบ่งออกเป็นสามกลุ่ม: ชนิดของแอนโดรเจนซึ่งยับยั้งการเจริญเติบโตของมดลูกและลดน้ำหนักของรังไข่ (กลุ่มนี้ยังรวมถึงฮอร์โมนของต่อมหมวกไตซึ่งมีผลคล้ายกัน); สารที่คล้ายคลึงกันในโครงสร้างกับเอสโตรเจนสังเคราะห์ เช่น ไซเนสทรอล ซึ่งมีผลเอสโตรเจนที่อ่อนแอ แต่ยับยั้งผลของเอสโตรเจนที่แรงกว่าที่ผลิตในร่างกาย (ไดเมทิลสทิล-เบสโทรล, ฟลอเรติน ฯลฯ); สารที่ไม่ใช่สเตียรอยด์และไม่มีโครงสร้างคล้ายคลึงกันกับเอสโตรเจนสังเคราะห์
เกสตาเกน

เช่นเดียวกับเอสโตรเจน พวกเขาเป็นฮอร์โมนเพศหญิง ตัวหลักคือโปรเจสเตอโรน มันถูกสังเคราะห์ใน corpus luteum ของรังไข่ เช่นเดียวกับในรกและต่อมหมวกไต corpus luteum ยังผลิต 17-hydroxyprogesterone
เช่นเดียวกับเอสโตรเจน มันมีผลเฉพาะกับองคชาตเป็นหลัก ผลกระทบบางอย่างของฮอร์โมนโปรเจสเตอโรนตรงกันข้ามกับฮอร์โมนเอสโตรเจน ในกรณีของการปฏิสนธิ ฮอร์โมนนี้จะยับยั้งการตกไข่ รักษาสภาพในมดลูกที่จำเป็นสำหรับการพัฒนาของทารกในครรภ์ และป้องกันการหดตัวของมัน ผลที่เป็นปฏิปักษ์ของฮอร์โมนโปรเจสเตอโรนยังแสดงออกในการปราบปรามการสร้างเคราตินของเยื่อบุผิวในช่องคลอดที่เกิดจากเอสโตรเจน ฮอร์โมนโปรเจสเตอโรนในปริมาณมากช่วยลดผลกระทบของเอสโตรเจนต่อเยื่อบุโพรงมดลูก
อย่างไรก็ตาม ความสัมพันธ์ระหว่างเอสโตรเจนและโปรเจสเตอโรนนั้นซับซ้อนกว่าความเป็นปรปักษ์กันมาก บ่อยครั้งที่ฮอร์โมนเหล่านี้ทำงานร่วมกัน การกระทำทางชีวภาพของฮอร์โมนโปรเจสเตอโรนในกรณีส่วนใหญ่เกิดขึ้นหลังจากการกระตุ้นฮอร์โมนเอสโตรเจน ร่วมกับพวกเขา gestagens ทำให้เกิดการเปลี่ยนแปลงในต่อมน้ำนม: ถ้าเอสโตรเจนยาวขึ้นและข้นในท่อแล้วโปรเจสเตอโรนจะช่วยเพิ่มการพัฒนาของถุงลม ภายใต้การกระทำของ gestagens บนมดลูกซึ่งถูกกระตุ้นโดยเอสโตรเจนก่อนหน้านี้การเจริญเติบโตและการหลั่งของต่อมเยื่อบุโพรงมดลูก การเปลี่ยนแปลงเกิดขึ้นในเซลล์ของสโตรมา - ขนาดของนิวเคลียสเพิ่มขึ้นเนื้อหาของเอนไซม์บางชนิดไกลโคโปรตีนเพิ่มขึ้น ฮอร์โมนโปรเจสเตอโรนเป็นสิ่งจำเป็นในการรักษาการตั้งครรภ์ แต่การกำจัด corpus luteum ทำให้เกิดการยุติการตั้งครรภ์เฉพาะในระยะเริ่มแรกเท่านั้น ต่อมามีการผลิตฮอร์โมนโปรเจสเตอโรนในรก
นอกจากผลกระทบเฉพาะต่ออวัยวะเป้าหมายแล้ว gestagens ยังส่งผลต่อกระบวนการต่างๆ ที่เกิดขึ้นในร่างกายอีกด้วย ดังนั้นโปรเจสเตอโรนจะกักเก็บน้ำและเกลือเพิ่มปริมาณไนโตรเจนในปัสสาวะ เพิ่มอุณหภูมิของร่างกายซึ่งสร้างสภาวะที่เหมาะสมที่สุดสำหรับการพัฒนาของไข่ที่ปฏิสนธิ มันมียากล่อมประสาทโดยตรงและในปริมาณมากมีผลยาเสพติด
นอกจากนี้ยังมีการอธิบายผลความดันโลหิตตกของ gestagens ทั้งในคลินิกและความดันโลหิตสูงในการทดลอง (Armstrong, 1959) Gestagens เพิ่มการหลั่งน้ำย่อยและยับยั้งการหลั่งน้ำดี
การกระทำของฮอร์โมนโปรเจสเตอโรนต่ออวัยวะต่อมไร้ท่อ เช่น เอสโตรเจน ขึ้นอยู่กับขนาดยา ดังนั้นปริมาณเล็กน้อยจึงกระตุ้นการทำงานของต่อมใต้สมองเพิ่มการหลั่งฮอร์โมน gonadotropic และปริมาณมากขัดขวางการผลิตของพวกเขาซึ่งจะช่วยป้องกันการเจริญเติบโตของรูขุมขนและการตกไข่
คุณสมบัติของ gestagens ในการยับยั้งการตกไข่ทำให้เกิดการคุมกำเนิดโดย Haberland ในปี 1921 เขาค้นพบภาวะมีบุตรยากชั่วคราวในสัตว์เมื่อถูกฝังด้วย corpus luteum หรือเนื้อเยื่อรก
นอกจากการออกฤทธิ์ของแอนติโกนาโดทรอปิกแล้ว โปรเจสเตอโรนยังส่งผลโดยตรงต่อรังไข่ ลดขนาดและยับยั้งการพัฒนาของรูขุมขน การบริหาร gestagens เข้าสู่ร่างกายเป็นเวลานานทำให้การทำงานของต่อมหมวกไตลดลง
ส่งผลต่อต่อมไทรอยด์ gestagens ทำให้ปริมาณไอโอดีนที่จับกับโปรตีนเพิ่มขึ้น และเพิ่มความสามารถในการจับกับไทรอกซีนของโกลบูลิน
ในปัจจุบัน มีการสังเคราะห์ยาสเตียรอยด์จำนวนมากที่มีผล progestational ที่แข็งแรงกว่าผลของ progesterone: chlormadinone acetate ซึ่งเป็น progestogen ที่ทรงพลังที่สุดซึ่งมีฤทธิ์มากกว่าฮอร์โมน progesterone ถึง 100 เท่า และมีผลเพียงเล็กน้อยต่อการทำงานของ gonadotropic ของต่อมใต้สมอง; medroxy-progesterone acetate - ออกฤทธิ์มากกว่าฮอร์โมนโปรเจสเตอโรนถึง 15 เท่าในแง่ของการออกฤทธิ์ต่ออุปกรณ์สืบพันธุ์และแอคทีฟมากกว่า 80 เท่าในแง่ของการออกฤทธิ์ของแอนติโกนาโดทรอปิก ฯลฯ
แอนโดรเจน

แอนโดรเจนเป็นฮอร์โมนเพศชาย ผลิตในร่างกายทั้งชายและหญิง ในผู้หญิงพวกเขาจะสังเคราะห์ส่วนใหญ่ในเขตไขว้กันเหมือนแหของเยื่อหุ้มสมองต่อมหมวกไต ฮอร์โมนเหล่านี้ผลิตในปริมาณเล็กน้อยในรังไข่เช่นกัน การหลั่งแอนโดรเจนในรังไข่เพิ่มขึ้นอย่างรวดเร็วในสภาวะทางพยาธิวิทยาบางอย่าง - รังไข่ polycystic และโดยเฉพาะอย่างยิ่งใน arrhenoblastomas (KD Smirnova, 1969) รังไข่ผลิตแอนโดรสเตนดิโอน เทสโทสเตอโรน และเอพิเทสโทสเตอโรนเป็นหลัก ฮอร์โมนสองตัวสุดท้ายถูกสังเคราะห์ในปริมาณที่มีนัยสำคัญในเนื้องอก กิจกรรมทางชีวภาพของแอนโดรเจนนั้นแตกต่างกัน กิจกรรมของแอนโดรสเตอโรน 100 ไมโครกรัมซึ่งเทียบเท่ากับกิจกรรมของเทสโทสเตอโรน 15 ไมโครกรัมถือเป็นหน่วยสากลของกิจกรรมทางชีวภาพ เช่นเดียวกับฮอร์โมนเพศทั้งหมด แอนโดรเจนส่งผลกระทบต่ออวัยวะสืบพันธุ์เป็นหลักและผลของมันขึ้นอยู่กับขนาดยา
แอนโดรเจนกระตุ้นการเจริญเติบโตของคลิตอริสทำให้เกิดการขยายตัวของริมฝีปากใหญ่และการฝ่อของผู้เยาว์และยังส่งผลต่อมดลูกและช่องคลอด
เป็นลักษณะเฉพาะที่ผลของแอนโดรเจนต่อมดลูกนั้นเกิดขึ้นเฉพาะในผู้หญิงที่มีรังไข่ทำงานนั่นคือกับพื้นหลังของความอิ่มตัวของฮอร์โมนเอสโตรเจน ในเวลาเดียวกันฮอร์โมนแอนโดรเจนในปริมาณเล็กน้อยทำให้เกิดการเปลี่ยนแปลงในเยื่อบุโพรงมดลูกก่อนกำหนดและปริมาณมากทำให้เกิดการฝ่อ ใน myometrium ด้วยการแนะนำในปริมาณมากความเร็วของการไหลเวียนของเลือดลดลง, การเกิดพังผืดและการเกิด hyperplasia cystic-glandular
ในช่องคลอด แอนโดรเจนมีผลคล้ายกับ gestagens นั่นคือพวกเขายับยั้งการแพร่กระจายของเยื่อเมือกที่เกิดจากฮอร์โมนเอสโตรเจน เมื่อปิดการทำงานของรังไข่ การให้แอนโดรเจนในปริมาณมากจะทำให้เยื่อบุช่องคลอดขยายตัว เห็นได้ชัดว่า เช่นเดียวกับ gestagens แอนโดรเจนสามารถทำหน้าที่เป็นยาเสริมฤทธิ์กันหรือเป็นปฏิปักษ์ของฮอร์โมนเอสโตรเจนขึ้นอยู่กับขนาดยา ดังนั้นแอนโดรเจนจำนวนเล็กน้อยจะเพิ่มผลของเอสโตรเจนต่อมดลูกและช่องคลอดของสัตว์ตอนตอนโต และปริมาณมากจะลดผลกระทบของฮอร์โมนเอสโตรเจน
แอนโดรเจนยับยั้งการก่อตัวของน้ำนมในต่อมน้ำนม ยับยั้งการหลั่งในมารดาที่ให้นมบุตร แอนโดรเจนในปริมาณเล็กน้อยกระตุ้นการผลิตฮอร์โมน gonadotropic โดยต่อมใต้สมองซึ่งจะกระตุ้นการเจริญเติบโตของรูขุมขนในรังไข่และปริมาณมากขัดขวางการทำงานของต่อมใต้สมอง ผลกระทบนี้พบการประยุกต์ใช้ในการรักษามะเร็งเต้านม เมื่อฮอร์โมนเทสโทสเตอโรนในปริมาณมากทำให้การหลั่งฮอร์โมน gonadotropic จากต่อมใต้สมองลดลงและการเปลี่ยนแปลงของแกร็นในรังไข่ (Ya. M. Bruskin,
1969).
แอนโดรเจนมีผลเด่นชัดต่อต่อมหมวกไต การศึกษาเชิงทดลองโดยผู้เขียนหลายคนแสดงให้เห็นว่าการบริหารฮอร์โมนเทสโทสเตอโรนเป็นเวลานานทำให้การทำงานของต่อมหมวกไตลดลง (MC Carty et al., 1966; Telegry et al., 1967) B. V. Epshtein (1968), D. E. Yankelevich และ M. 3 Yurchenko (1969) สังเกตการปราบปรามการทำงานของต่อมหมวกไตเมื่อใช้ยาแอนโดรเจนในคลินิก
เห็นได้ชัดว่าผลกระทบของแอนโดรเจนต่อสถานะการทำงานของต่อมหมวกไตก็ขึ้นอยู่กับขนาดยาเช่นกัน ตาม I. N. Efimov (1968), Roy et al. (1969) ฮอร์โมนเหล่านี้ในปริมาณน้อยจะลดการทำงานของต่อมหมวกไตและฮอร์โมนที่มีขนาดใหญ่จะกระตุ้นมัน ในเวลาเดียวกัน Kitay et al. (1966) รายงานผลลัพธ์ที่ตรงกันข้าม
แอนโดรเจนกระตุ้นการทำงานของเกาะเล็กเกาะน้อย Langerhans ของตับอ่อนโดยมีฤทธิ์ต้านเบาหวาน
ผู้หญิงมักผลิตแอนโดรเจนน้อยกว่าผู้ชาย อย่างไรก็ตาม ด้วยเนื้องอกที่ออกฤทธิ์ทางฮอร์โมน เช่นเดียวกับถุงน้ำหลายใบ () รังไข่สามารถผลิตสารแอนโดรเจนได้จำนวนมาก ซึ่งนำไปสู่ลักษณะทางเพศชายรองในผู้หญิง
สามารถสังเกตได้เช่นเดียวกันสำหรับแอนโดรเจนที่สังเคราะห์โดยเยื่อหุ้มสมองต่อมหมวกไตของผู้หญิง ดังนั้นหากโดยปกติฮอร์โมนแอนโดรเจนจำนวนเล็กน้อย dehydroepiandrosterone เกิดขึ้นในเขตไขว้กันเหมือนแหของเยื่อหุ้มสมองต่อมหมวกไตจากนั้นด้วยการทำงานของต่อมหมวกไตที่มากเกินไปและยิ่งกว่านั้นด้วยเนื้องอกแอนโดรเจนจำนวนมากจะถูกปล่อยออกมาซึ่งทำให้เกิดการติดเชื้อ
นอกจากผลกระทบที่เด่นชัดต่ออวัยวะสืบพันธุ์แล้ว แอนโดรเจนยังเกี่ยวข้องกับการควบคุมการเผาผลาญโปรตีน ไขมัน และแร่ธาตุอีกด้วย
โดยเฉพาะอย่างยิ่งสิ่งบ่งชี้คือผลกระตุ้นของแอนโดรเจนต่อการสังเคราะห์โปรตีน ผลกระทบที่เรียกว่า anabolic นี้เกิดจากการสังเคราะห์โปรตีนที่เพิ่มขึ้นใน ribosomal RNA ซึ่งนำไปสู่การกักเก็บไนโตรเจน การเพิ่มขึ้นของการสังเคราะห์โปรตีนเกิดขึ้นอย่างเข้มข้นที่สุดในเนื้อเยื่อของกล้ามเนื้อ ผลแอนโบลิกของแอนโดรเจนนี้อธิบายการพัฒนากล้ามเนื้อในผู้ชายที่แข็งแรงกว่าในผู้หญิง (Zachmann et al., 1966)
นอกจากการกักเก็บไนโตรเจนในร่างกายแล้ว แอนโดรเจนยังทำให้เกิดการสะสมของฟอสฟอรัสและโพแทสเซียม ซึ่งเป็นส่วนประกอบของโปรตีนเนื้อเยื่อ เช่นเดียวกับการกักเก็บโซเดียมและคลอรีน และลดการขับยูเรีย
แอนโดรเจนเร่งการเจริญเติบโตของกระดูกและการแข็งตัวของกระดูกอ่อน epiphyseal พวกเขายังมีผลต่อการสร้างเม็ดเลือด เพิ่มจำนวนเซลล์เม็ดเลือดแดงและฮีโมโกลบิน
คุณสมบัติของแอนโดรเจนในการเพิ่มการสังเคราะห์โปรตีนเป็นสาเหตุของการสร้างฮอร์โมนอนาโบลิกสเตียรอยด์ทั้งกลุ่ม สารดังกล่าวใช้กันอย่างแพร่หลายในคลินิกเพื่อรักษาผู้ป่วยหลังการผ่าตัดด้วยภาวะทุพโภชนาการ ฯลฯ แอนโดรเจนเด่นชัดและการกระทำ anabolic ที่แข็งแกร่ง ฮอร์โมนดังกล่าวคือ 1/-เอทิล-19-นอร์เทสโทสเตอโรน (ไนล์วาร์, นอร์เอธาน-โดรโลน) ซึ่งมีฤทธิ์แอนโดรเจนน้อยกว่าฮอร์โมนเทสโทสเตอโรนถึง 16 เท่า (รูปที่ 12), เนโรโบล (ไดอานาโบล), เนโรโบลิล (ดูราโบลิน), เรตาโบลิล นอร์โบเลตัน, ออกซานโดรโลน เป็นต้น .
สารต้านแอนโดรเจน. ยาเหล่านี้ใช้รักษาสิว ขนดก ขนดก ในเด็กผู้หญิง เป็นต้น Hammerstein (1973) อธิบายหนึ่งในยาต่อต้านแอนโดรเจนที่มีประสิทธิภาพสูง - ไซโปรเตอโรน อะซิเตท ซึ่งนอกจากจะออกฤทธิ์ต้านแอนโดรเจนแล้ว ยังมีคุณสมบัติคุมกำเนิดอีกด้วย การใช้งานทำให้เนื้อหาของโปรเจสเตอโรนในเลือดลดลงอย่างรวดเร็ว
กลไกการออกฤทธิ์ของฮอร์โมนสเตียรอยด์
แม้จะทราบดีถึงอิทธิพลของฮอร์โมนสเตียรอยด์ในด้านต่างๆ ของการเผาผลาญอาหาร แต่กลไกของการกระทำในระดับเซลล์และโมเลกุลยังไม่เป็นที่เข้าใจกันดีนัก ความสำเร็จในทิศทางนี้ประสบความสำเร็จในการศึกษาคุณสมบัติทางกายภาพของฮอร์โมนสเตียรอยด์ที่เกี่ยวข้องกับโครงสร้างทางเคมี
ดังนั้น หากเราจินตนาการถึงโมเลกุลสเตียรอยด์ที่อยู่บนระนาบของแผ่นกระดาษ กลุ่มเมทิลเชิงมุมจะถูกวางไว้เหนือระนาบนี้ กลุ่มที่ฉายไปในทิศทางเดียวกันเรียกว่า "cis" และกลุ่มที่คาดการณ์ในทิศทางตรงกันข้ามเรียกว่า "ทรานส์" เมื่อเขียนสูตรโครงสร้าง การฉายภาพเหล่านี้จะแสดงด้วยเส้นทึบและเส้นประตามลำดับ ความแตกต่างเชิงพื้นที่เหล่านี้ทำให้โมเลกุลสเตียรอยด์มีคุณสมบัติทางเคมีและชีวภาพที่แตกต่างกัน
เนื่องจากการเปลี่ยนแปลงการจัดวางเชิงพื้นที่ของโมเลกุลสเตียรอยด์ทำให้เกิดการเปลี่ยนแปลงในกิจกรรมทางชีวภาพ จึงเป็นเรื่องปกติที่จะสรุปว่าการกระทำทางเภสัชวิทยาของสเตียรอยด์มีความสัมพันธ์อย่างใกล้ชิดกับโครงสร้างทางเคมีของพวกมัน เห็นได้ชัดว่าความหลากหลายของผลกระทบของฮอร์โมนเหล่านี้ต่อร่างกายนั้นเป็นไปได้เนื่องจากการมีกลไกทั่วไปของการกระทำในเซลล์ การถอดรหัสกลไกเหล่านี้เป็นสาระสำคัญของการตอบสนองทางเภสัชวิทยาหลักที่เกิดจากสเตียรอยด์
อย่างไรก็ตามการเลือกการกระทำของฮอร์โมนในอวัยวะต่าง ๆ ไม่ได้ขึ้นอยู่กับโครงสร้างทางเคมีของพวกมัน เมื่อไหลเวียนในเลือดจะไปถึงเซลล์ของอวัยวะและเนื้อเยื่อทั้งหมดและสะสมเฉพาะในอวัยวะเป้าหมายบางส่วนเท่านั้นในเซลล์ที่มีสารโปรตีนพิเศษ - ตัวรับที่เข้าสู่พันธะเคมีกับฮอร์โมน ปัจจุบันได้ทำการศึกษาน้ำหนักโมเลกุลและคุณลักษณะอื่นๆ รวมทั้งจำนวนโมเลกุลของตัวรับในเซลล์และความจุของพันธะที่ทำให้มั่นใจได้ว่ามีการคำนวณปฏิสัมพันธ์กับสเตียรอยด์แล้ว ดังนั้นหนึ่งเซลล์ของเยื่อบุผิวของมดลูกมีตัวรับ 2,000-2500 ตัวที่ผูกกับเอสตราไดออล
ดังนั้นการทำงานร่วมกันของฮอร์โมนสเตียรอยด์กับโมเลกุลตัวรับในเซลล์จึงเป็นหนึ่งในเงื่อนไขสำหรับกลไกระดับโมเลกุลของการเปลี่ยนแปลงทางชีวเคมีที่ซับซ้อนที่ตามมาในอวัยวะและเนื้อเยื่อ
มีข้อสันนิษฐานหลายประการเกี่ยวกับกลไกที่เป็นไปได้ของการกระทำของสเตียรอยด์ในเซลล์ (AM Utevsky, 1965): ฮอร์โมนทำหน้าที่บนพื้นผิวของเซลล์ เปลี่ยนการซึมผ่านของเมมเบรน โต้ตอบกับระบบเอนไซม์ ควบคุมการทำงานของยีน
เนื่องจากการทำงานของเยื่อหุ้มเซลล์นั้นเชื่อมโยงอย่างแยกไม่ออกกับการกระทำของเอนไซม์ "ฝัง" ในเยื่อหุ้มเหล่านี้และอุปกรณ์ของข้อมูลทางพันธุกรรมทำงานตามหลักการ "หนึ่งยีน - หนึ่งเอนไซม์" เมื่อวิเคราะห์จุดของการประยุกต์ใช้การกระทำของ ฮอร์โมนสเตียรอยด์ใด ๆ ผลกระทบต่อเอนไซม์ที่แยกได้นั้นมาถึงระบบด้านหน้าและเอนไซม์
จากมุมมองนี้ กลไกการออกฤทธิ์ของเอสโตรเจนได้รับการศึกษาอย่างดีที่สุด (Gorski et al., 1965; O. I. Epifanova, 1965; P. V. Sergeev, R. D. Seifulla, A. I. Maisky, 1971; S. S. Laguchev, 1975) ตามที่ Gorski และเพื่อนร่วมงานกล่าว ปฏิสัมพันธ์ระดับโมเลกุลของเอสโตรเจนกับอวัยวะเป้าหมายเกิดขึ้นในสามขั้นตอน และอิทธิพลของพวกมันที่มีต่อเครื่องมือทางพันธุกรรมของเซลล์เป็นผลจากการกระทำในภายหลัง อย่างแรก โมเลกุลเอสโตรเจนแบบสเตอริโอจับกับโมเลกุลตัวรับในเซลล์ จากนั้นกิจกรรมทางชีววิทยาของโมเลกุลตัวรับจะเปลี่ยนไป และในขั้นตอนสุดท้าย การสังเคราะห์อาร์เอ็นเอ กลูโคส ฟอสโฟลิปิด และโปรตีนจะเพิ่มขึ้น
ฮอร์โมนหลายชนิด และโดยหลักแล้วจะกระตุ้นฮอร์โมน (ฮอร์โมนของต่อมใต้สมองและไฮโปทาลามัส) ซึ่งทำหน้าที่ในเซลล์ กระตุ้นการทำงานของเอนไซม์อะดีนิลไซคเลสที่แปลเป็นภาษาท้องถิ่นในเยื่อหุ้มเซลล์ ซึ่งสัมพันธ์กับตัวรับที่จำเพาะสำหรับฮอร์โมนแต่ละชนิด สิ่งนี้จะเพิ่มหรือลดปริมาณของไซคลิก 3", 5"-กรดโมโนฟอสฟอริก (3", 5"-AMP) ซึ่งจะกระตุ้นองค์ประกอบภายในเซลล์
ดังนั้น 3",5"-AMP จึงเป็นเสมือนตัวกลางภายในเซลล์ที่ช่วยรับรองการถ่ายโอนผลกระทบของฮอร์โมนต่อระบบเอนไซม์ภายในเซลล์ มีหลักฐานว่าฮอร์โมนสเตียรอยด์ยังทำหน้าที่ทางอ้อมผ่าน 3",5"-AMP
การสังเคราะห์ฮอร์โมนสเตียรอยด์ทางเพศมีลักษณะทั่วไป และระยะเริ่มต้นซึ่งเกิดขึ้นทั้งในรังไข่และในต่อมหมวกไตและอัณฑะนั้นเหมือนกัน
Pregnenoloneซึ่งมีกิจกรรมของฮอร์โมนที่อ่อนแอตามแนวคิดสมัยใหม่ เป็นสารหลักที่ฮอร์โมนจะก่อตัวขึ้นในอวัยวะต่อมไร้ท่อต่างๆ ในลำดับนี้ pregnenolone สังเคราะห์ขึ้นในต่อมหมวกไต อัณฑะ รูขุมขน corpus luteum และ ovarian stroma (Hall, Koritz, 1964; Ryan, Smith, 1965; Ryan, Petro, 1966) ขั้นตอนเหล่านี้ในการเปลี่ยนโคเลสเตอรอลไปเป็น pregnenolone มีความน่าสนใจเป็นพิเศษเนื่องจากการทำงานของฮอร์โมน luteinizing ในระดับของพวกมัน (Ryan, 1969)
การเปลี่ยนจากอะซิเตทเป็นโคเลสเตอรอลเกิดขึ้นในส่วนที่ละลายน้ำได้และไมโครโซมอลเซลล์ และจากโคเลสเตอรอลไปเป็นพรีนโนโลนในเศษส่วนของไมโตคอนเดรีย
การก่อตัวของ gestagens
การเปลี่ยน pregnenolone เป็น progesterone สามารถทำได้ในอวัยวะต่อมไร้ท่อทั้งหมดที่สังเคราะห์สเตียรอยด์อย่างไรก็ตามเนื่องจากความจำเพาะของระบบเอนไซม์จึงมีชัยใน corpus luteum และบางส่วนในรูขุมขน โปรเจสเตอโรนถูกหลั่งออกมาไม่เปลี่ยนแปลงหรือเนื่องจากการลดลงของ 20 คีโตนของโปรเจสเตอโรนไปยังกลุ่ม 20a-ไฮดรอกซิลของเมตาโบไลต์ มันจึงกลายเป็นโปรเจสโตเจนที่ออกฤทธิ์อีกตัวหนึ่ง - 20a-oxypregn-4-en-3-one (Dorfman, Ungar, 1965 ).
การเปลี่ยนแปลงเพิ่มเติมของ pregnenolone สามารถเกิดขึ้นได้ทั้งผ่านทางฮอร์โมนโปรเจสเตอโรนและฮอร์โมนแอนโดรเจน ซึ่งแสดงโดยแผนภาพด้านล่าง (อ้างอิงจาก Ryan, 1961)
การก่อตัวของแอนโดรเจนเกิดขึ้นอย่างเด่นชัดในอัณฑะ แต่ยังอยู่ในต่อมหมวกไต รูขุมขน คอร์ปัส luteum หรือสโตรมาของรังไข่โดย 17-hydroxylation ของ pregnenolone หรือ progesterone (Dorfman, 1962; Ryan, 1965, 1969)
ปฏิกิริยาสำหรับการก่อตัวของสารประกอบ 17-hydroxy เกิดขึ้นในส่วนของ microsomal ของเซลล์ ในขณะที่ปฏิกิริยา dehydrogenase รวมทั้งการเปลี่ยน testosterone และ androstenedione เกิดขึ้นในระบบเอนไซม์ที่ละลายน้ำได้
androstenedione ที่สังเคราะห์ขึ้นนั้นถูกหลั่งโดยรังไข่ซึ่งเห็นได้ชัดว่าเป็นแหล่งหลักของสเตียรอยด์ในเลือดของผู้หญิง
การก่อตัวของเอสโตรเจน
เอสโตรเจนเกิดขึ้นจากแอนโดรสเตนดิโอนหรือเทสโทสเตอโรนระหว่างปฏิกิริยาอะโรมาไทเซชัน (การก่อตัวของพันธะไม่อิ่มตัวสามพันธะในวงแหวนสเตียรอยด์ A) ซึ่งเกิดขึ้นในเศษส่วนของเซลล์ไมโครโซมอล (Ryan, 1963) ปฏิกิริยานี้สามารถเกิดขึ้นได้ในเซลล์ stroma, cortical layer, hilus และ granulosa ของรังไข่ในรูขุมขน, corpus luteum และในปริมาณที่แน่นอนในต่อมหมวกไตและอัณฑะ
มีหลายเส้นทางสำหรับการสังเคราะห์ทางชีวเคมีของเอสโตรเจน ดังนั้น เอสตราไดออลสามารถเกิดขึ้นได้จากฮอร์โมนเทสโทสเตอโรน และเอสโทรนจากแอนโดรสเตนดิโอน นอกจากนี้ เอสตราไดออลและเอสโทรนยังสามารถแปลงสภาพได้เนื่องจากการทำงานของเอนไซม์สเตียรอยด์ดีไฮโดรจีเนสที่มีอยู่ในเนื้อเยื่อของร่างกายจำนวนมาก Estriol ถูกสังเคราะห์ในรังไข่และเป็นผลมาจากการเผาผลาญของ estrone และ estradiol - ในตับและอวัยวะอื่น ๆ
การสังเคราะห์ฮอร์โมนสเตียรอยด์เกิดขึ้นภายใต้การทำงานของระบบเอนไซม์ที่เฉพาะเจาะจงมาก แต่เนื่องจากแต่ละวิถีทางสำหรับการก่อตัวของโปรเจสเตอโรน แอนโดรเจนและเอสโตรเจนนั้นเชื่อมโยงกันอย่างใกล้ชิด และความสามารถในการสังเคราะห์ทางชีวสังเคราะห์ของเนื้อเยื่อที่ผลิตฮอร์โมนนั้นเกิดขึ้นพร้อมกันเป็นส่วนใหญ่ การก่อตัวที่โดดเด่นของฮอร์โมนหนึ่งหรืออื่นขึ้นอยู่กับการแปลของเอ็นไซม์ ดังนั้น ในการสังเคราะห์ทางชีวสังเคราะห์ของสเตียรอยด์เพศทั้งหมด บทบาทสำคัญอยู่ที่ 3|3-ออล-สเตียรอยด์ดีไฮโดรจีเนส ซึ่งจะแปลง pregnenolone เป็นฮอร์โมนโปรเจสเตอโรน เอนไซม์นี้พบได้ในอวัยวะต่อมไร้ท่อจำนวนมาก ดังนั้นระยะแรกของการสร้างสเตียรอยด์สามารถเกิดขึ้นได้ทั้งในรังไข่และในเยื่อหุ้มสมองต่อมหมวกไต ขั้นตอนต่อไปในการก่อตัวของแอนโดรเจน gestagens และ estrogens เนื่องจากเอ็นไซม์แปลเป็นภาษาท้องถิ่นที่แตกต่างกันส่วนใหญ่ดำเนินการในอวัยวะต่อมไร้ท่ออย่างน้อยหนึ่งอวัยวะ
การดำรงอยู่ของวิถีทั่วไปสำหรับการแลกเปลี่ยนและการสังเคราะห์ฮอร์โมนสเตียรอยด์ยังอธิบายความจริงที่ว่าในแต่ละต่อมที่ผลิตสเตียรอยด์นั้นฮอร์โมนอื่น ๆ ในกลุ่มนี้จำนวนเล็กน้อยก็เกิดขึ้นเช่นกัน ดังนั้นนอกเหนือจากรังไข่แล้วฮอร์โมนเอสโตรเจนจำนวนเล็กน้อยยังถูกผลิตขึ้นในต่อมหมวกไต โปรเจสเตอโรนถูกสร้างขึ้นนอกเหนือจาก corpus luteum ในรูขุมขนและต่อมหมวกไตและแอนโดรเจน - ในรังไข่และต่อมหมวกไต
การละเมิดเมแทบอลิซึมของฮอร์โมนสเตียรอยด์ในต่อมไร้ท่อซึ่งมักเกี่ยวข้องกับการเปลี่ยนแปลงของเอนไซม์สามารถนำไปสู่การสะสมในร่างกายของสารที่เป็นผลิตภัณฑ์ขั้นกลางของการสังเคราะห์ทางชีวภาพและมักจะมีในปริมาณเล็กน้อยเท่านั้น ดังนั้นความไม่เพียงพอของเอนไซม์ที่เปลี่ยนแอนโดรเจนเป็นเอสโตรเจน (เอนไซม์อะโรมาไทเซชัน) อาจทำให้แอนโดรเจนในร่างกายของผู้หญิงเพิ่มขึ้นอย่างรวดเร็วและการเกิดโรคไวรัส ความบกพร่องของเอนไซม์ (D5,3 | 3-ol-steroid dehydrogenase ซึ่งทำหน้าที่ในขั้นตอนการเปลี่ยน pregnenolone เป็น progesterone เช่นเดียวกับเอนไซม์ aromatizing ที่เกี่ยวข้องกับการเปลี่ยน androstenedione และ testosterone เป็น estrogens) อาจเป็นสาเหตุได้ (E. A. Bogdanova , 1969) .
ความจริงที่ว่าแอนโดรเจนเป็นสารตั้งต้นของเอสโตรเจนในการสังเคราะห์ทางชีวภาพของหลังได้รับการยืนยันจากข้อมูลการทดลองและทางคลินิกจำนวนมาก ในการทดลองระหว่างการฟักตัวของเนื้อเยื่อส่วนต่างๆ ของรกและรังไข่ที่มีฮอร์โมนแอนโดรเจนที่ติดฉลากคาร์บอน พบว่ามีการเปลี่ยนแอนโดรสเตนดิโอนไปเป็นเอสโตรน ในคลินิกในการรักษามะเร็งเต้านมด้วยแอนโดรเจนในปริมาณมาก (testosterone propionate) พบว่ามีการขับเอสโตรเจนเพิ่มขึ้นเล็กน้อย