गोनैडोट्रोपिक हार्मोन: एफएसएच, एलएच, एलटीएच। गोनैडोट्रोपिक हार्मोन और उनके कार्य पिट्यूटरी ग्रंथि के गोनैडोट्रोपिक कार्य:
गोनैडोट्रोपिन-रिलीजिंग हार्मोन (GnRH), जिसे ल्यूटिनाइजिंग हार्मोन-रिलीजिंग हार्मोन (LHRH) और ल्यूलिबरिन के रूप में भी जाना जाता है, एक ट्रॉफिक पेप्टाइड हार्मोन है जो एडेनोहाइपोफिसिस से कूप-उत्तेजक हार्मोन (FSH) और ल्यूटिनाइजिंग हार्मोन (LH) की रिहाई के लिए जिम्मेदार है। GnRH हाइपोथैलेमस में GnRH न्यूरॉन्स से संश्लेषित और जारी किया जाता है। पेप्टाइड गोनैडोट्रोपिन-रिलीजिंग हार्मोन के परिवार से संबंधित है। यह हाइपोथैलेमिक-पिट्यूटरी-अधिवृक्क अक्ष प्रणाली के प्रारंभिक चरण का प्रतिनिधित्व करता है।
संरचना
जीएनआरएच की पहचान विशेषताओं को 1977 में नोबेल पुरस्कार विजेता रोजर गुइलमिन और एंड्रयू डब्लू। स्कैली द्वारा परिष्कृत किया गया था: पायरोग्लू-हिज-ट्रैप-सेर-टायर-ग्लाइ-ले-आर्ग-प्रो-ग्लाइ-एनएच 2। पेप्टाइड्स का प्रतिनिधित्व करने के लिए हमेशा की तरह, अनुक्रम एन-टर्मिनस से सी-टर्मिनस तक दिया जाता है; चिरलिटी नोटेशन को छोड़ना भी मानक है, इस धारणा के साथ कि सभी अमीनो एसिड अपने एल-फॉर्म में हैं। संक्षिप्ताक्षर मानक प्रोटीनोजेनिक अमीनो एसिड को संदर्भित करता है, जिसमें पाइरोग्लू, पाइरोग्लूटामिक एसिड, ग्लूटामिक एसिड का व्युत्पन्न शामिल है। सी-टर्मिनस पर NH2 इंगित करता है कि एक मुक्त कार्बोक्सिलेट में समाप्त होने के बजाय, श्रृंखला एक कार्बोक्सामाइड में समाप्त होती है।
संश्लेषण
GnRH के लिए GNRH1 अग्रदूत जीन गुणसूत्र 8 पर स्थित होता है। स्तनधारियों में, सामान्य टर्मिनल डिकैप्टाइड को प्रीऑप्टिक पूर्वकाल हाइपोथैलेमस में 92-एमिनो एसिड प्री-प्रोहोर्मोन से संश्लेषित किया जाता है। यह हाइपोथैलेमिक-पिट्यूटरी-एड्रेनल अक्ष प्रणाली के विभिन्न नियामक तंत्रों के लिए एक लक्ष्य है, जो शरीर में एस्ट्रोजन के बढ़ते स्तर से बाधित होते हैं।
कार्यों
GnRH को माध्यिका श्रेष्ठता पर पोर्टल शिरा के पिट्यूटरी परिसंचरण में स्रावित किया जाता है। पोर्टल शिरापरक परिसंचरण GnRH को पिट्यूटरी ग्रंथि तक ले जाता है, जिसमें गोनैडोट्रोपिक कोशिकाएं होती हैं, जहां GnRH अपने स्वयं के रिसेप्टर्स, गोनैडोट्रोपिन-रिलीजिंग हार्मोन रिसेप्टर्स, सात जी-प्रोटीन युग्मित ट्रांसमेम्ब्रेन रिसेप्टर्स को सक्रिय करता है, जो फॉस्फॉइनोसाइटाइड फॉस्फोलिपेज़ सी के बीटा आइसोफॉर्म को उत्तेजित करता है, जो कैल्शियम और प्रोटीन किनेज सी को जुटाने के लिए आगे बढ़ता है। इससे गोनैडोट्रोपिन एलएच और एफएसएच के संश्लेषण और स्राव में शामिल प्रोटीन की सक्रियता होती है। GnRH कुछ ही मिनटों में प्रोटियोलिसिस के दौरान साफ हो जाता है। बचपन के दौरान GnRH गतिविधि बहुत कम होती है, और यौवन या किशोरावस्था के दौरान बढ़ जाती है। प्रजनन अवधि के दौरान, फीडबैक लूप के नियंत्रण में सफल प्रजनन कार्य के लिए स्पंदनात्मक गतिविधि महत्वपूर्ण है। हालांकि, गर्भावस्था के दौरान GnRH गतिविधि की आवश्यकता नहीं होती है। हाइपोथैलेमस और पिट्यूटरी ग्रंथि के रोगों में, या उनकी शिथिलता के साथ (उदाहरण के लिए, हाइपोथैलेमस के कार्य का दमन), या कार्बनिक क्षति (आघात, ट्यूमर) के कारण पल्सेटिव गतिविधि ख़राब हो सकती है। ऊंचा प्रोलैक्टिन का स्तर GnRH गतिविधि को कम करता है। इसके विपरीत, हाइपरिन्सुलिनमिया स्पंदनात्मक गतिविधि को बढ़ाता है, जिसके परिणामस्वरूप बिगड़ा हुआ एलएच और एफएसएच गतिविधि होती है, जैसा कि पॉलीसिस्टिक अंडाशय सिंड्रोम में देखा जाता है। कल्मन सिंड्रोम में GnRH संश्लेषण जन्मजात रूप से अनुपस्थित होता है।
एफएसएच और एलएच विनियमन
पिट्यूटरी ग्रंथि में, GnRH गोनैडोट्रोपिन, कूप-उत्तेजक हार्मोन (FSH) और ल्यूटिनाइजिंग हार्मोन (LH) के संश्लेषण और स्राव को उत्तेजित करता है। इन प्रक्रियाओं को जीएनआरएच रिलीज दालों के आकार और आवृत्ति के साथ-साथ एण्ड्रोजन और एस्ट्रोजेन से प्रतिक्रिया द्वारा नियंत्रित किया जाता है। कम आवृत्ति जीएनआरएच दालें एफएसएच रिलीज का कारण बनती हैं, जबकि उच्च आवृत्ति जीएनआरएच दालें एलएच रिलीज को उत्तेजित करती हैं। महिलाओं और पुरुषों के बीच GnRH स्राव में अंतर होता है। पुरुषों में, GnRH एक स्थिर दर पर दालों में स्रावित होता है, जबकि महिलाओं में, मासिक धर्म चक्र के दौरान दालों की दर भिन्न होती है, और ओव्यूलेशन से ठीक पहले एक बड़ी GnRH नाड़ी होती है। GnRH स्राव सभी कशेरुकियों में स्पंदनशील होता है [वर्तमान में इस कथन की शुद्धता के लिए कोई सबूत नहीं है - स्तनधारियों की एक छोटी संख्या के लिए केवल अनुभवजन्य सहायक सबूत] और सामान्य प्रजनन कार्य को बनाए रखने के लिए आवश्यक है। इस प्रकार, एक एकल हार्मोन, GnRH1, महिलाओं में कूपिक वृद्धि, ओव्यूलेशन और कॉर्पस ल्यूटियम विकास की जटिल प्रक्रिया को नियंत्रित करता है, साथ ही पुरुषों में शुक्राणुजनन भी।
न्यूरोहोर्मोन
जीएनआरएच न्यूरोहोर्मोन को संदर्भित करता है, विशिष्ट तंत्रिका कोशिकाओं में उत्पादित हार्मोन और उनके न्यूरोनल सिरों से मुक्त होते हैं। GnRH उत्पादन का प्रमुख क्षेत्र हाइपोथैलेमस का प्रीऑप्टिक क्षेत्र है, जिसमें अधिकांश न्यूरॉन्स होते हैं जो GnRH का स्राव करते हैं। जीएनआरएच-स्रावित न्यूरॉन्स नाक के ऊतकों में उत्पन्न होते हैं और मस्तिष्क में चले जाते हैं, जहां वे औसत दर्जे का सेप्टम और हाइपोथैलेमस में फैलते हैं और बहुत लंबे (> 1 मिमी लंबे) डेंड्राइट्स से जुड़े होते हैं। वे एक सामान्य सिनैप्टिक इनपुट साझा करने के लिए एक साथ बंडल करते हैं, जो उन्हें GnRH रिलीज को सिंक्रनाइज़ करने की अनुमति देता है। जीएनआरएच-स्रावित न्यूरॉन्स कई अलग-अलग ट्रांसमीटरों (नॉरपेनेफ्रिन, जीएबीए, ग्लूटामेट सहित) के माध्यम से कई अलग-अलग अभिवाही न्यूरॉन्स द्वारा नियंत्रित होते हैं। उदाहरण के लिए, डोपामाइन एस्ट्रोजन-प्रोजेस्टेरोन प्रशासन के बाद महिलाओं में एलएच रिलीज (जीएनआरएच के माध्यम से) को उत्तेजित करता है; डोपामाइन पोस्ट-ओफोरेक्टॉमी महिलाओं में एलएच रिलीज को रोक सकता है। किस-पेप्टिन GnRH रिलीज का एक महत्वपूर्ण नियामक है, जिसे एस्ट्रोजन द्वारा भी नियंत्रित किया जा सकता है। यह नोट किया गया है कि किसपेप्टिन-स्रावित न्यूरॉन्स हैं जो एस्ट्रोजन रिसेप्टर अल्फा को भी व्यक्त करते हैं।
अन्य अंगों पर प्रभाव
GnRH हाइपोथैलेमस और पिट्यूटरी ग्रंथि के अलावा अन्य अंगों में पाया गया है, लेकिन अन्य जीवन प्रक्रियाओं में इसकी भूमिका को कम समझा जाता है। उदाहरण के लिए, GnRH1 के प्लेसेंटा और सेक्स ग्रंथियों को प्रभावित करने की संभावना है। GnRH और GnRH रिसेप्टर्स स्तन, डिम्बग्रंथि, प्रोस्टेट और एंडोमेट्रियल कैंसर कोशिकाओं में भी पाए गए हैं।
व्यवहार पर प्रभाव
उत्पादन/विमोचन व्यवहार को प्रभावित करता है। Cichlid मछली, जो एक सामाजिक प्रभुत्व तंत्र का प्रदर्शन करती है, बदले में GnRH स्राव के अपग्रेडेशन का अनुभव करती है, जबकि Cichlids, जो सामाजिक रूप से निर्भर हैं, GnRH स्राव के डाउनरेगुलेशन का अनुभव करते हैं। स्राव के अलावा, सामाजिक वातावरण के साथ-साथ व्यवहार GnRH-स्रावित न्यूरॉन्स के आकार को प्रभावित करते हैं। विशेष रूप से, जो पुरुष अधिक अलग होते हैं, उनमें पुरुषों की तुलना में बड़े GnRH-स्रावित न्यूरॉन्स होते हैं जो कम अलग होते हैं। मादाओं में अंतर भी देखा जाता है, प्रजनन मादाओं में नियंत्रण मादाओं की तुलना में छोटे जीएनआरएच-स्रावित न्यूरॉन्स होते हैं। ये उदाहरण बताते हैं कि GnRH एक सामाजिक रूप से विनियमित हार्मोन है।
चिकित्सा आवेदन
प्राकृतिक GnRH को पहले मानव रोग के उपचार के लिए गोनाडोरेलिन हाइड्रोक्लोराइड (Factrel) और गोनाडोरेलिन डायसेटेटटेट्राहाइड्रेट (Cistorelin) के रूप में निर्धारित किया गया है। आधे जीवन को बढ़ाने के लिए GnRH डिकैप्टाइड की संरचना में संशोधन ने GnRH1 एनालॉग्स का निर्माण किया है जो या तो उत्तेजित करते हैं (GnRH1 एगोनिस्ट) या दबाने (GnRH प्रतिपक्षी) गोनाडोट्रोपिन। इन सिंथेटिक एनालॉग्स ने नैदानिक उपयोग के लिए प्राकृतिक हार्मोन को बदल दिया है। ल्यूप्रोरेलिन एनालॉग का उपयोग स्तन कार्सिनोमा, एंडोमेट्रियोसिस, प्रोस्टेट कार्सिनोमा के उपचार में और 1980 के दशक में अध्ययन के बाद एक निरंतर जलसेक के रूप में किया जाता है। असामयिक यौवन के इलाज के लिए येल विश्वविद्यालय के डॉ. फ्लोरेंस कॉमिट सहित कई शोधकर्ताओं द्वारा इसका उपयोग किया गया है।
जानवरों का यौन व्यवहार
GnRH गतिविधि यौन व्यवहार में अंतर को प्रभावित करती है। GnRH का ऊंचा स्तर महिलाओं में यौन प्रदर्शन व्यवहार को बढ़ाता है। GnRH की शुरूआत ग्रिफॉन-हेडेड ज़ोनोट्रिचिया में मैथुन (एक प्रकार का संभोग समारोह) की आवश्यकता को बढ़ाती है। स्तनधारियों में, GnRH प्रशासन महिलाओं के यौन प्रदर्शन व्यवहार को बढ़ाता है, जैसा कि नर को पीछे के छोर को दिखाने और पूंछ को नर की ओर ले जाने में लंबी-पूंछ वाले धूर्त (विशालकाय चिड़िया) की कम विलंबता में देखा गया है। GnRH का बढ़ा हुआ स्तर पुरुषों में टेस्टोस्टेरोन गतिविधि को बढ़ाता है, प्राकृतिक टेस्टोस्टेरोन के स्तर की गतिविधि से अधिक। आक्रामक क्षेत्रीय मुठभेड़ के तुरंत बाद नर पक्षियों को GnRH का प्रशासन एक आक्रामक क्षेत्रीय मुठभेड़ के दौरान स्वाभाविक रूप से देखे गए स्तरों की तुलना में टेस्टोस्टेरोन के स्तर में वृद्धि का परिणाम है। GnRH प्रणाली के बिगड़ने के साथ, प्रजनन शरीर क्रिया विज्ञान और मातृ व्यवहार पर प्रतिकूल प्रभाव देखा जाता है। एक सामान्य GnRH प्रणाली के साथ मादा चूहों की तुलना में, GnRH-स्रावित न्यूरॉन्स की संख्या में 30% की कमी के साथ मादा चूहों की संतानों की देखभाल कम होती है। इन चूहों के पिल्लों को एक साथ छोड़ने की संभावना अधिक होती है, और पिल्लों को खोजने में अधिक समय लगेगा।
पशु चिकित्सा में आवेदन
मवेशियों में सिस्टिक डिम्बग्रंथि रोग के उपचार के रूप में प्राकृतिक हार्मोन का उपयोग पशु चिकित्सा में भी किया जाता है। डेस्लोरेलिन का सिंथेटिक एनालॉग पशु चिकित्सा प्रजनन नियंत्रण में निरंतर रिलीज इम्प्लांट के साथ प्रयोग किया जाता है।
:टैग
प्रयुक्त साहित्य की सूची:
कैंपबेल आरई, गैदामाका जी, हान एसके, हर्बिसन एई (जून 2009)। "डेंड्रो-डेंड्रिटिक बंडलिंग और गोनैडोट्रोपिन-रिलीज़िंग हार्मोन न्यूरॉन्स के बीच साझा सिनेप्स"। संयुक्त राज्य अमेरिका के राष्ट्रीय विज्ञान अकादमी की कार्यवाही 106 (26): 10835-40। doi:10.1073/pnas.0903463106. पीएमसी 2705602. पीएमआईडी 19541658।
ब्राउन आरएम (1994)। न्यूरोएंडोक्रिनोलॉजी का परिचय। कैम्ब्रिज, यूके: कैम्ब्रिज यूनिवर्सिटी प्रेस। आईएसबीएन 0-521-42665-0।
एहलर्स के, हाल्वर्सन एल (2013)। "गोनैडोट्रोपिन-रिलीज़िंग हार्मोन (GnRH) और GnRH रिसेप्टर (GnRHR)"। महिला चिकित्सा की वैश्विक पुस्तकालय। doi: 10.3843 / GLOWM.10285। 5 नवंबर 2014 को लिया गया।
कोरियोनिक गोनाडोट्रोपिन, गर्भावस्था, प्रोफाज़ी, गोनाकोर, होरागोनवर्गीकरण
गोनैडोट्रोपिक हार्मोनकार्रवाई की प्रणाली
गोनैडोट्रोपिक, ल्यूटिनाइजिंग। गोनाडल कोशिकाओं के विशिष्ट झिल्ली रिसेप्टर्स के साथ बातचीत करता है, एडिनाइलेट साइक्लेज सिस्टम को सक्रिय करता है और पूर्वकाल पिट्यूटरी ग्रंथि के ल्यूटिनाइजिंग हार्मोन के प्रभावों को पुन: उत्पन्न करता है। महिलाओं में, यह ओव्यूलेशन को प्रेरित और उत्तेजित करता है, कूप के टूटने और कॉर्पस ल्यूटियम में इसके परिवर्तन को बढ़ावा देता है, मासिक धर्म चक्र के ल्यूटियल चरण में कॉर्पस ल्यूटियम की कार्यात्मक गतिविधि को बढ़ाता है, इसके अस्तित्व को लंबा करता है, मासिक धर्म की शुरुआत में देरी करता है। , प्रोजेस्टेरोन और एण्ड्रोजन के उत्पादन को बढ़ाता है, सहित। कॉर्पस ल्यूटियम अपर्याप्तता के मामले में, अंडे के आरोपण को बढ़ावा देता है और नाल के विकास का समर्थन करता है। ओव्यूलेशन आमतौर पर प्रशासन के 32-36 घंटे बाद हासिल किया जाता है। पुरुषों में, यह वृषण लेडिग कोशिकाओं के कार्य को उत्तेजित करता है, टेस्टोस्टेरोन के संश्लेषण और उत्पादन को बढ़ाता है, शुक्राणुजनन को बढ़ावा देता है, माध्यमिक यौन विशेषताओं का विकास और अंडकोष के अंडकोश में उतरता है। इंट्रामस्क्युलर रूप से प्रशासित होने पर यह रक्त में अच्छी तरह से अवशोषित हो जाता है। एक उत्परिवर्तजन प्रभाव नहीं है। गर्भवती महिलाओं को इसका सेवन करने से गर्भस्थ शिशु पर प्रतिकूल प्रभाव पड़ सकता है।नियुक्ति के लिए संकेत
हाइपोथैलेमिक-पिट्यूटरी विकारों में गोनाड का हाइपोफंक्शन: महिलाओं में - बांझपन,पिट्यूटरी-डिम्बग्रंथि की शिथिलता के कारण,
समेत कूप की परिपक्वता और एंडोमेट्रियल प्रसार की प्रारंभिक उत्तेजना के बाद,
उल्लंघन,
अनुपस्थिति सहित
मासिक धर्म,
प्रसव की उम्र में अक्रियाशील गर्भाशय रक्तस्राव,
कॉर्पस ल्यूटियम के कार्य की अपर्याप्तता,
गर्भावस्था की पहली तिमाही में आदतन और संभावित गर्भपात,
कृत्रिम गर्भाधान के दौरान नियंत्रित "सुपरवुलेशन"; पुरुषों में - हाइपोगोनैडोट्रोपिक हाइपोगोनाडिज्म,
नपुंसकता की घटना,
हाइपोजेनिटलिज़्म,
वृषण हाइपोप्लासिया,
एडिपोसोजेनिटल सिंड्रोम,
शुक्राणुजनन विकार (ऑलिगोस्पर्मिया,
अशुक्राणुता),
क्रिप्टोर्चिडिज़्म।
मतभेद
अतिसंवेदनशीलता, सहित। अन्य गोनैडोट्रोपिन, पिट्यूटरी हाइपरट्रॉफी या ट्यूमर, हार्मोन-निर्भर ट्यूमर या जननांग अंगों की सूजन संबंधी बीमारियां, हृदय और गुर्दे की विफलता, ब्रोन्कियल अस्थमा, मिर्गी, माइग्रेन; महिलाओं में - डिम्बग्रंथि हाइपरस्टिम्यूलेशन सिंड्रोम या इसका खतरा, अनियंत्रित दुष्क्रियात्मक गर्भाशय रक्तस्राव, गर्भाशय फाइब्रॉएड, सिस्ट या डिम्बग्रंथि अतिवृद्धि जो इसके पॉलीसिस्टिक रोग से जुड़ी नहीं है, तीव्र चरण में थ्रोम्बोफ्लिबिटिस; पुरुषों में - प्रोस्टेट कैंसर, समय से पहले यौवन (क्रिप्टोर्चिडिज्म के उपचार के लिए)। उपयोग के लिए प्रतिबंध: पॉलीसिस्टिक अंडाशय (ओव्यूलेशन प्रेरण के लिए), 4 वर्ष से कम उम्र के बच्चे। गर्भावस्था और स्तनपान के दौरान उपयोग करें: गर्भावस्था के दौरान, भ्रूण पर प्रतिकूल प्रभाव की संभावना पर विचार किया जाना चाहिए।प्रवेश नियम
वी / एम, 500-3000 आईयू / दिन की खुराक में पुरुष - सप्ताह में 2-3 बार, 4-6 सप्ताह के अंतराल पर 4 सप्ताह के पाठ्यक्रम। 6-12 महीनों के लिए 3-6 पाठ्यक्रम किए जाते हैं। चक्र के 10-12 वें दिन से शुरू होने वाले एनोवुलेटरी चक्र वाली महिलाओं के लिए, 2-3 दिनों के अंतराल के साथ 3000 आईयू 2-3 बार या 1500 आईयू 6-7 हर दूसरे दिन बार। यौन शिशुवाद की घटना के साथ पिट्यूटरी बौनापन के साथ - 500-1000 आईयू 1-2 बार 1-2 महीने के लिए 1-2 महीने के लिए दोहराया पाठ्यक्रमों में। क्रिप्टोर्चिडिज्म के साथ, 10 वर्ष से कम उम्र के बच्चे - 500-1000 आईयू, 10-14 वर्ष पुराना - 1500 आईयू 2 सप्ताह में एक बार 4-6 सप्ताह के लिए दोहराए गए पाठ्यक्रमों में या लगातार 4-5 महीने तक।विश्लेषण नियंत्रण
जब ओव्यूलेशन प्रेरण के लिए उपयोग किया जाता है, तो खुराक के आहार की एक व्यक्तिगत पसंद और प्रभावशीलता के आधार पर इसके सुधार, सीरम एस्ट्राडियोल और प्रोजेस्टेरोन सांद्रता के नियमित माप, डिम्बग्रंथि अल्ट्रासाउंड, बेसल शरीर के तापमान का दैनिक निर्धारण और एक डॉक्टर द्वारा अनुशंसित यौन जीवन के पालन की सिफारिश की जाती है। . अतिवृद्धि के विकास या डिम्बग्रंथि के सिस्ट के गठन के लिए उपचार की एक अस्थायी समाप्ति (सिस्ट के टूटने से बचने के लिए), संभोग से परहेज और अगले पाठ्यक्रम के लिए खुराक में कमी की आवश्यकता होती है। महत्वपूर्ण डिम्बग्रंथि अतिवृद्धि या मेनोट्रोपिन या यूरोफोलिट्रोपिन के साथ उपचार के अंतिम दिन रक्त सीरम में एस्ट्राडियोल की एकाग्रता में अत्यधिक वृद्धि के साथ, इस चक्र में ओव्यूलेशन प्रेरण नहीं किया जाता है। पुरुषों में बांझपन के उपचार के दौरान, शुक्राणुओं की संख्या और गतिशीलता को निर्धारित करने के लिए प्रशासन से पहले और बाद में रक्त सीरम में टेस्टोस्टेरोन की एकाग्रता को मापना आवश्यक है। क्रिप्टोर्चिडिज़्म के उपचार के दौरान समय से पहले यौवन के साथ, चिकित्सा रद्द कर दी जाती है और उपचार के अन्य तरीकों का उपयोग किया जाता है। यदि 10 खुराक लेने के बाद वृषण वंश की कोई गतिशीलता नहीं है, तो उपचार जारी रखने की अनुशंसा नहीं की जाती है। युवा पुरुषों में हाइपोगोनाडिज्म का निदान प्रशासन से पहले रक्त सीरम में टेस्टोस्टेरोन की एकाग्रता के नियंत्रण में किया जाता है और उपचार के एक दिन बाद (सामान्य वृषण समारोह के साथ, चिकित्सा के बाद एकाग्रता 2 गुना बढ़नी चाहिए)। खुराक या प्रशासन की अवधि में अनुचित वृद्धि पुरुषों में स्खलन में शुक्राणुओं की संख्या में कमी के साथ हो सकती है।दुष्प्रभाव
तंत्रिका तंत्र और संवेदी अंगों से: सिरदर्द, चिड़चिड़ापन, चिंता, थकान, कमजोरी, अवसाद। एलर्जी प्रतिक्रियाएं: दाने (जैसे पित्ती, एरिथेमेटस), एंजियोएडेमा, डिस्पेनिया। अन्य: एंटीबॉडी का निर्माण (लंबे समय तक उपयोग के साथ), स्तन वृद्धि, इंजेक्शन स्थल पर दर्द। जननांग प्रणाली से: महिलाओं में - डिम्बग्रंथि अतिवृद्धि, डिम्बग्रंथि अल्सर का गठन, डिम्बग्रंथि हाइपरस्टिम्यूलेशन सिंड्रोम, कई गर्भावस्था, परिधीय शोफ; पुरुषों में - समय से पहले यौवन, वंक्षण नहर में अंडकोष में वृद्धि, जिससे उनके लिए आगे उतरना मुश्किल हो जाता है, गोनाड का अध: पतन, वीर्य नलिकाओं का शोष।संश्लेषण को कम करें (प्रतिलेखन को दबाता है) प्रोलैक्टोस्टैटिन (डोपामाइन है)। स्राव को उत्तेजित करेंस्तनपान, गर्भावस्था, यौन संपर्क की आवृत्ति में वृद्धि, तनाव, नींद, सेरोटोनिन, एस्ट्रोजेन, एंजियोटेंसिन के दौरान निपल्स की जलन
डाइहाइड्रॉक्सीफेनिलएलनिन (डीओपीए) के स्राव को कम करता है।
कार्रवाई की प्रणाली
ठीक से ज्ञात नहीं है। दूसरे मेसेंजर पेप्टाइड M-1500 की उपस्थिति के प्रमाण हैं, जो कैसिइनोजेन के संश्लेषण को उत्तेजित करता है।
लक्ष्य और प्रभाव
गुर्दे में, पैराथाइरॉइड हार्मोन और वृद्धि हार्मोन के साथ, यह विटामिन डी के हाइड्रॉक्सिलेशन और सक्रियण को उत्तेजित करता है।
o महिला सेक्स हार्मोन, कॉर्टिकोस्टेरॉइड्स और इंसुलिन के पर्याप्त स्तर की उपस्थिति में स्तन ग्रंथि के विकास और उसके दुद्ध निकालना को उत्तेजित करता है,
गर्भावस्था के दौरान कॉर्पस ल्यूटियम की गतिविधि और प्रोजेस्टेरोन के स्राव का समर्थन करता है, o कैसिइनोजेन आरएनए, लैक्टोज सिंथेज़ और डीएनए के संश्लेषण को बढ़ाता है,
o मातृ वृत्ति को बनाए रखने में भाग लेता है।
o लेडिग कोशिकाओं में टेस्टोस्टेरोन के संश्लेषण को बढ़ाता है, o प्रोस्टेट ग्रंथि और उसके स्राव को उत्तेजित करता है,
o शुक्राणुजनन और शुक्राणु गतिविधि पर एलएच और एफएसएच की क्रिया को प्रबल करता है।
विकृति विज्ञान
हाइपोफंक्शन
शीहान सिंड्रोम - एक जोखिम कारक बच्चे के जन्म के दौरान अत्यधिक रक्त की हानि है, जो बिगड़ा हुआ रक्त की आपूर्ति और पिट्यूटरी ग्रंथि के परिगलन की ओर जाता है। पहला संकेत दुद्ध निकालना की समाप्ति है, फिर हाइपोपिट्यूटारिज्म के अन्य लक्षण पाए जाते हैं।
हाइपरफंक्शन कारण।हाइपोथायरायडिज्म, हार्मोन-उत्पादक के साथ अतिरिक्त संश्लेषण होता है
ट्यूमर, पुरानी गुर्दे की विफलता।
नैदानिक तस्वीर।नतीजतन, पुरुषों और महिलाओं में बांझपन, पुरुषों में नपुंसकता और गाइनेकोमास्टिया, महिलाओं में एमेनोरिया और गैलेक्टोरिया विकसित होता है।
प्रसवोत्तर स्तनपान के दौरान बढ़े हुए हार्मोन का स्तर अंडाशय पर थोड़ा सा एनोवुलेटरी प्रभाव डालता है, जिससे गर्भावस्था की संभावना कम हो सकती है।
जी ओनाडोट्रोपिक हार्मोन
इनमें कूप-उत्तेजक (FSH) और ल्यूटिनाइजिंग (LH) हार्मोन शामिल हैं।
हम, मानव कोरियोगोनिन।
संरचना
FSH और LH ग्लाइकोप्रोटीन हैं जिनका आणविक भार 30 kDa है। कोरियोगोनिन एक प्लेसेंटल हार्मोन है और एक ग्लाइकोप्रोटीन भी है। ये सभी हार्मोन हैं
सबयूनिट α और β से मिलकर बनता है, प्रत्येक हार्मोन का β-सबयूनिट अलग-अलग होता है, उनका α-सबयूनिट समान होता है और थायराइड-उत्तेजक हार्मोन के α-सबयूनिट के समान होता है।
संश्लेषण
पिट्यूटरी ग्रंथि के गोनैडोट्रॉफ़्स में होता है।
संश्लेषण और स्राव का विनियमन
गोनाडोलिबरिन लगभग 90 के चक्र के साथ तरंगों में संश्लेषण और स्राव को सक्रिय करता है।
गोनैडोलिबरिन के संश्लेषण के दमन के माध्यम से अप्रत्यक्ष रूप से एंडोर्फिन और सेक्स हार्मोन के संश्लेषण को कम करें। सेक्स हार्मोन, उनकी एकाग्रता के आधार पर, इन हार्मोनों के स्राव को सीधे दबा देते हैं।
कार्रवाई की प्रणाली
ऐडीनाइलेट साइक्लेज।
लक्ष्य और प्रभाव
पुरुषों में ल्यूटिनाइजिंग हार्मोन
हे लेडिग कोशिकाओं में कोलेस्ट्रॉल और आगे टेस्टोस्टेरोन के संश्लेषण को बढ़ाता है।
पर महिला ल्यूटिनाइजिंग हार्मोन
हे कॉर्पस ल्यूटियम में कोलेस्ट्रॉल, प्रोजेस्टेरोन और एण्ड्रोजन के संश्लेषण को बढ़ाता है,
o एस्ट्राडियोल पर निर्भर एकाग्रता में वृद्धि के परिणामस्वरूप ओव्यूलेशन की शुरुआत होती है।
विकृति विज्ञान
हाइपोफंक्शन
फॉलिकल स्टिम्युलेटिंग हॉर्मोन
हे वीर्य नलिकाओं, अंडकोषों के विकास को उत्तेजित करता है, शुक्राणुओं को आरंभ करता है-
हे वृषण सर्टोली कोशिकाओं पर कार्य करता है और एण्ड्रोजन-बाध्यकारी प्रोटीन के संश्लेषण को बढ़ाता है, जो रक्त से कब्जा सुनिश्चित करता है और टेस्टोस्टेरोन को अर्धवृत्ताकार नलिकाओं और एपिडीडिमिस तक पहुंचाता है। यह आपको इस स्थान पर टेस्टोस्टेरोन की एकाग्रता को बढ़ाने और शुक्राणुजनन को प्रोत्साहित करने की अनुमति देता है।
फॉलिकल स्टिम्युलेटिंग हॉर्मोन
हे रोम के विकास को सक्रिय करता है और उन्हें एलएच की क्रिया के लिए तैयार करता है,
हे एण्ड्रोजन के एस्ट्रोजेन में रूपांतरण को बढ़ाता है।
o बच्चों में देर से यौवन होता है,
ओ महिलाओं में - ओलिगोमेनोरिया, ओव्यूलेशन की कमी और बांझपन, स्तन और जननांगों का शोष,
पुरुषों में - नपुंसकता, अशुक्राणुता, वृषण शोष,
o दोनों लिंगों में - कामेच्छा में कमी, शरीर के बालों का बढ़ना, त्वचा का पतला होना और उसकी झुर्रियाँ।
हाइपरफंक्शन
एफएसएच में वृद्धि से अक्सर असफल गर्भाशय रक्तस्राव होता है।
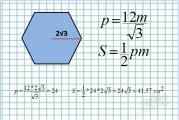
पूर्वकाल पिट्यूटरी ग्रंथि से तीन गोनैडोट्रोपिक हार्मोन निकाले गए: कूप-उत्तेजक (FSH), ल्यूटिनाइजिंग (LH) और ल्यूटोट्रोपिक (LTH)।
तीनों हार्मोन अंडाशय को प्रभावित करते हैं - रोम की वृद्धि और विकास, कॉर्पस ल्यूटियम का निर्माण और कार्य। हालांकि, प्रारंभिक अवस्था में रोम का विकास गोनैडोट्रोपिक हार्मोन पर निर्भर नहीं करता है और हाइपोफिसेक्टोमी के बाद भी होता है।
एफएसएच पूर्वकाल लोब के परिधीय क्षेत्रों में स्थित छोटे गोल बेसोफिल द्वारा बनता है। यह हार्मोन उस अवस्था में कार्य करता है जब अंडा ग्रेन्युलोसा की कई परतों से घिरा हुआ एक बड़ा अंडाणु होता है। एफएसएच ग्रैनुलोसा कोशिकाओं के प्रसार और कूपिक द्रव के स्राव का कारण बनता है।
एलएच पूर्वकाल लोब के मध्य भाग में स्थित बेसोफिल द्वारा बनता है। महिलाओं में, यह हार्मोन ओव्यूलेशन और कूप के कॉर्पस ल्यूटियम में परिवर्तन को बढ़ावा देता है। पुरुषों में, यह एक हार्मोन है जो अंतरालीय कोशिकाओं (जीएसआईके) को उत्तेजित करता है।
दोनों हार्मोन - एफएसएच और एलएच रासायनिक संरचना और भौतिक रासायनिक गुणों में समान हैं। वे मासिक धर्म चक्र के दौरान स्रावित होते हैं, और उनका अनुपात इसके चरण के आधार पर भिन्न होता है। उनकी कार्रवाई में, एफएसएच और एलएच सहक्रियावादी हैं, और लगभग सभी जैविक प्रभाव उनके संयुक्त स्राव के साथ किए जाते हैं।
एलटीएच, या प्रोलैक्टिन, पिट्यूटरी ग्रंथि के एसिडोफिल द्वारा निर्मित होता है। यह हार्मोन कॉर्पस ल्यूटियम पर कार्य करता है, इसके अंतःस्रावी कार्य का समर्थन करता है। बच्चे के जन्म के बाद, यह दूध के स्राव को प्रभावित करता है। इसलिए, एफएसएच और एलएच द्वारा लक्षित अंगों की प्रारंभिक उत्तेजना के बाद इस हार्मोन की कार्रवाई की जाती है। एलटीएच एफएसएच के स्राव को दबा देता है, जो स्तनपान के दौरान मासिक धर्म की अनुपस्थिति से जुड़ा है।
गर्भावस्था के दौरान, कोरियोनिक गोनाडोट्रोपिन (सीजी) प्लेसेंटल ऊतक में बनता है, जो कि पिट्यूटरी गोनाडोट्रोपिक हार्मोन से संरचना में भिन्न होता है, लेकिन एलएच के समान जैविक प्रभाव होता है, जिसका उपयोग हार्मोन थेरेपी में किया जाता है।
गोनैडोट्रोपिक हार्मोन की जैविक क्रिया. अंडाशय पर गोनैडोट्रोपिक हार्मोन का मुख्य प्रभाव अप्रत्यक्ष है, इसके हार्मोन के स्राव की उत्तेजना के माध्यम से, जिसके कारण हार्मोनल उत्पादन में एक विशिष्ट उतार-चढ़ाव के साथ एक पिट्यूटरी-डिम्बग्रंथि चक्र बनाया जाता है।
पिट्यूटरी ग्रंथि के गोनैडोट्रोपिक कार्य और अंडाशय की गतिविधि के बीच एक संबंध है जो मासिक धर्म चक्र के नियमन में एक प्रमुख भूमिका निभाता है। पिट्यूटरी ग्रंथि के गोनैडोट्रोपिक हार्मोन की एक छोटी मात्रा का अंडाशय के हार्मोन उत्पादन पर उत्तेजक प्रभाव पड़ता है, जिससे रक्त में स्टेरॉयड हार्मोन की एकाग्रता में वृद्धि होती है। दूसरी ओर, डिम्बग्रंथि हार्मोन की सामग्री में उल्लेखनीय वृद्धि संबंधित पिट्यूटरी हार्मोन के स्राव को रोकती है।
यह बातचीत एक तरफ एफएसएच और एलएच और दूसरी तरफ एस्ट्रोजेन और प्रोजेस्टेरोन के बीच विशेष रूप से स्पष्ट है। फॉलिकल्स की वृद्धि और विकास, साथ ही एस्ट्रोजन का स्राव, एफएसएच द्वारा प्रेरित होता है, हालांकि एलएच की उपस्थिति भी एस्ट्रोजन के पूर्ण उत्पादन के लिए आवश्यक है। एस्ट्रोजन के ओव्यूलेशन में उल्लेखनीय वृद्धि एफएसएच के स्राव को रोकता है और एलएच को उत्तेजित करता है। , जिसके प्रभाव में कॉर्पस ल्यूटियम विकसित होता है, एलटीएच के स्राव के साथ उत्तरार्द्ध की स्रावी गतिविधि बढ़ जाती है। परिणामी प्रोजेस्टेरोन, बदले में, एलएच के स्राव को दबा देता है, और एफएसएच और एलएच के कम स्राव के साथ, मासिक धर्म होता है। पिट्यूटरी और अंडाशय का यह चक्रीय कार्य पिट्यूटरी-डिम्बग्रंथि चक्र का गठन करता है, जिसके परिणामस्वरूप ओव्यूलेशन और मासिक धर्म होता है।
गोनैडोट्रोपिक हार्मोन का स्राव न केवल चक्र के चरण पर निर्भर करता है, बल्कि उम्र पर भी निर्भर करता है। रजोनिवृत्ति के दौरान डिम्बग्रंथि समारोह की समाप्ति के साथ, पिट्यूटरी ग्रंथि की गोनैडोट्रोपिक गतिविधि 5 गुना से अधिक बढ़ जाती है, जो स्टेरॉयड हार्मोन के निरोधात्मक प्रभाव की अनुपस्थिति से जुड़ी होती है। इस मामले में, एफएसएच का स्राव प्रबल होता है।
एलटीएच की जैविक क्रिया पर बहुत कम आंकड़े हैं। यह माना जाता है कि एलटीएच स्तन ग्रंथियों के विकास और विकास को तेज करता है, स्तन ग्रंथि में प्रोटीन जैवसंश्लेषण सहित लैक्टेशन और बायोसिंथेटिक प्रक्रियाओं को उत्तेजित करता है।
गोनैडोट्रोपिक हार्मोन का चयापचय. गोनैडोट्रोपिक हार्मोन के आदान-प्रदान का पर्याप्त अध्ययन नहीं किया गया है। वे अपेक्षाकृत लंबे समय तक रक्त में प्रसारित होते हैं, सीरम में अलग-अलग वितरित किए जा रहे हैं: एफएसएच ए 1- और बी 2-ग्लोब्युलिन के अंशों में केंद्रित है, और एलएच एल्ब्यूमिन और बी 1-ग्लोब्युलिन के अंशों में केंद्रित है। शरीर में उत्पादित सभी गोनैडोट्रोपिन मूत्र में उत्सर्जित होते हैं। रक्त और मूत्र से पृथक गोनैडोट्रोपिक हार्मोन के भौतिक रासायनिक गुणों की समानता के बावजूद, रक्त गोनाडोट्रोपिन की जैविक गतिविधि मूत्र की तुलना में बहुत अधिक है। संभवतः, हार्मोन का निष्क्रिय होना यकृत में होता है, हालांकि इसका कोई प्रत्यक्ष प्रमाण नहीं है।
हार्मोन की क्रिया का तंत्र. हार्मोन की क्रिया के तंत्र का अध्ययन बहुत रुचि का है, क्योंकि चयापचय के कई पहलुओं पर हार्मोन के प्रभाव को जाना जाता है। शरीर पर हार्मोन, विशेष रूप से स्टेरॉयड श्रृंखला की कार्रवाई में यह विविधता कोशिका पर उनकी कार्रवाई के सामान्य तंत्र की उपस्थिति में स्पष्ट रूप से संभव है।
लेबल किए गए 3H और 125I हार्मोन के साथ प्रयोगात्मक अध्ययनों के परिणामों से पता चला है कि लक्ष्य अंगों की कोशिकाओं में हार्मोन की "पहचान" का एक तंत्र होता है, जिसके कारण हार्मोन एक विशेष कोशिका में जमा हो जाता है। वर्तमान में, यह सिद्ध माना जा सकता है कि कोशिका पर हार्मोन का प्रभाव अत्यधिक विशिष्ट प्रोटीन अणुओं - रिसेप्टर्स से जुड़ा होता है। दो प्रकार के रिसेप्शन हैं - स्टेरॉयड हार्मोन के लिए, जो अपेक्षाकृत आसानी से सेल (इंट्रासेल्युलर रिसेप्शन) में प्रवेश करते हैं, और प्रोटीन हार्मोन के लिए, जो लगभग सेल (झिल्ली रिसेप्शन) में प्रवेश नहीं करते हैं। पहले मामले में, रिसेप्टर तंत्र कोशिका के साइटोप्लाज्म में स्थित होता है और हार्मोन की क्रिया को स्वयं निर्धारित करता है, दूसरे मामले में यह मध्यस्थ के गठन को सुनिश्चित करता है। प्रत्येक हार्मोन अपने विशिष्ट रिसेप्टर से बांधता है। रिसेप्टर प्रोटीन मुख्य रूप से इस हार्मोन के लिए लक्षित अंगों में स्थानीयकृत होते हैं, लेकिन हार्मोन की कार्रवाई का व्यापक स्पेक्ट्रम, विशेष रूप से स्टेरॉयड वाले, अन्य अंगों में रिसेप्टर्स की उपस्थिति का सुझाव देते हैं।
एक कोशिका पर एक हार्मोन की क्रिया में पहला कदम एक प्रोटीन के लिए इसका बंधन और एक हार्मोन-रिसेप्टर कॉम्प्लेक्स का निर्माण होता है। यह प्रक्रिया प्रतिवर्ती है और एंजाइमों की भागीदारी के बिना होती है। रिसेप्टर्स में हार्मोन के साथ सीमित बाध्यकारी क्षमता होती है, जो कोशिका को अतिरिक्त जैविक रूप से सक्रिय पदार्थों में प्रवेश करने से रोकती है।
स्टेरॉयड हार्मोन की क्रिया का मुख्य बिंदु कोशिका नाभिक है। योजनाबद्ध रूप से, यह कल्पना की जा सकती है कि गठित हार्मोन-रिसेप्टर कॉम्प्लेक्स, कुछ परिवर्तन के बाद, नाभिक में प्रवेश करता है, जिसके परिणामस्वरूप एक विशिष्ट मैसेंजर आरएनए को संश्लेषित किया जाता है, विशिष्ट एंजाइमेटिक प्रोटीन कोशिकाओं के साइटोप्लाज्म में इसके मैट्रिक्स पर संश्लेषित होते हैं, जिसके कार्य हार्मोन की क्रिया को सुनिश्चित करते हैं।
पेप्टाइड हार्मोन की क्रिया, जिसमें गोनाडोट्रोपिन शामिल हैं, एडिनिलसाइक्लेज सिस्टम पर उनके प्रभाव से शुरू होती है, जो कोशिका झिल्ली में "निर्मित" होती है। पिट्यूटरी हार्मोन, कोशिकाओं पर कार्य करते हुए, कोशिका झिल्ली (एडेनिल साइक्लेज) में स्थानीयकृत एक एंजाइम को सक्रिय करते हैं, जो प्रत्येक हार्मोन के लिए एक विशिष्ट रिसेप्टर से जुड़ा होता है। यह एंजाइम आंतरिक झिल्ली सतह पर साइटोप्लाज्म में एटीपी से चक्रीय 31,5!-एडेनोसिन मोनोफॉस्फेट (सीएमपी) के गठन को बढ़ावा देता है। रिसेप्टर के साथ कॉम्प्लेक्स में गठित सीएमपी, जो एंजाइम सीएमपी-निर्भर प्रोटीन किनेज का एक सबयूनिट है, कई एंजाइमों (फॉस्फोरिलेज बी किनेज, लाइपेज बी) और अन्य प्रोटीन के फॉस्फोराइलेशन को सक्रिय करता है। प्रोटीन फास्फारिलीकरण ग्लाइकोजन के टूटने और आईटी पॉलीसोम में प्रोटीन संश्लेषण को उत्तेजित करता है। डी।
इस प्रकार, गोनैडोट्रोपिक हार्मोन की क्रिया के तंत्र में दो प्रकार के रिसेप्टर प्रोटीन शामिल हैं: झिल्ली हार्मोन रिसेप्टर्स और सीएमपी रिसेप्टर। नतीजतन, सीएमपी निकला, जैसा कि यह था, एक इंट्रासेल्युलर मध्यस्थ जो एंजाइमी सिस्टम पर हार्मोन के प्रभाव के हस्तांतरण को सुनिश्चित करता है।
मानव हार्मोन विभिन्न संरचनाओं के कार्बनिक पदार्थ हैं। उनके शारीरिक महत्व के अनुसार, उन्हें दो समूहों में विभाजित किया जाता है: तथाकथित प्रारंभिक हार्मोन जो अंतःस्रावी ग्रंथियों (हाइपोथैलेमस और पिट्यूटरी ग्रंथि के हार्मोन) की गतिविधि को उत्तेजित करते हैं, और हार्मोन-कलाकार जो शरीर के कुछ कार्यों को सीधे प्रभावित करते हैं।
पिट्यूटरी ग्रंथि के गोनैडोट्रोपिक हार्मोन
वे अंडाशय की गतिविधि को उत्तेजित करते हैं। ऐसे तीन हार्मोन की पहचान की गई है: कूप-उत्तेजक (एफएसएच), जो डिम्बग्रंथि के रोम के विकास को बढ़ावा देता है; ल्यूटिनाइजिंग (एलएच), रोम के ल्यूटिनाइजेशन का कारण बनता है; ल्यूटोट्रोपिक (एलटीएच), मासिक धर्म चक्र के दौरान कॉर्पस ल्यूटियम के कार्य का समर्थन करता है और लैक्टोट्रोपिक प्रभाव रखता है।
एफएसएच और एलएच रासायनिक संरचना (दोनों ग्लाइकोप्रोटीन हैं) के साथ-साथ भौतिक रासायनिक गुणों में समान हैं। इससे उन्हें अपने शुद्ध रूप में पिट्यूटरी ग्रंथि से अलग करना बहुत मुश्किल हो जाता है। हालांकि, एफएसएच और एलएच की संरचनात्मक समानता स्पष्ट रूप से एक विशेष भूमिका निभाती है, क्योंकि इन हार्मोन की संयुक्त कार्रवाई के तहत डिम्बग्रंथि गतिविधि का विनियमन किया जाता है।
एफएसएच (सापेक्ष आणविक भार 30,000) पूर्वकाल पिट्यूटरी ग्रंथि के परिधीय क्षेत्रों में स्थित छोटे गोल बेसोफिल बनाते हैं। इन कोशिकाओं के केंद्रक आकार में अनियमित होते हैं, और कोशिका द्रव्य में ग्लाइकोप्रोटीन के बड़ी संख्या में कणिकाएँ होती हैं।
एलएच (सापेक्ष आणविक भार 30,000) पूर्वकाल लोब के मध्य भाग में स्थित बेसोफिल बनाते हैं। इनके केन्द्रक भी आकार में अनियमित होते हैं, कोशिकाद्रव्य में अनेक बेसोफिलिक कणिकाएँ होती हैं। एफएसएच और एलएच अणुओं में एक कार्बोहाइड्रेट घटक होता है, जिसमें हेक्सोज, फ्रुक्टोज, हेक्सोसामाइन और सियालिक एसिड शामिल हैं।
दोनों हार्मोनों की शारीरिक गतिविधि डाइसल्फ़ाइड बांड की उपस्थिति और सिस्टीन और सिस्टीन की उच्च सामग्री से निर्धारित होती है।
चूंकि एफएसएच और एलएच सहक्रियावादी हैं और उनकी क्रिया के लगभग सभी जैविक प्रभाव - रोम का विकास, ओव्यूलेशन, सेक्स हार्मोन का स्राव - एक संयुक्त रिलीज के साथ किया जाता है, अंगों और प्रणालियों पर उनके जटिल प्रभाव पर विचार करना तर्कसंगत है।
वर्तमान आंकड़ों के अनुसार, अत्यधिक शुद्ध एफएसएच तैयारी अंडाशय में रोम के विकास को प्रोत्साहित नहीं करती है, जबकि एलएच का एक छोटा सा मिश्रण उनकी वृद्धि और परिपक्वता का कारण बनता है। Callantie (1965) यह दिखाने में सक्षम था कि अंडाशय पर FSH का विशिष्ट प्रभाव कूपिक कोशिकाओं के नाभिक में डीएनए संश्लेषण को प्रोत्साहित करना है। अधिक हाल के अध्ययनों से पता चला है कि इसके लिए एस्ट्रोजेन की एक साथ कार्रवाई की आवश्यकता होती है (मैंगो एट अल।, 1972; रेटर एट अल।, 1972)।
गोनाडोट्रोपिन डिम्बग्रंथि के वजन और इसलिए प्रोटीन संश्लेषण को बढ़ाने के लिए जाने जाते हैं। वे प्रोटीन और कार्बोहाइड्रेट चयापचय में शामिल कई एंजाइमों की गतिविधि को बढ़ाते हैं।
पिट्यूटरी ग्रंथि में एफएसएच और एलएच की एकाग्रता धीरे-धीरे यौवन की शुरुआत की ओर बढ़ जाती है। विभिन्न उम्र के लोगों में गोनैडोट्रोपिक हार्मोन की जैविक गतिविधि समान नहीं होती है। तो, लड़कियों के मूत्र से पृथक एफएसएच वयस्क महिलाओं और अनुभव करने वाली महिलाओं के मूत्र से पृथक की तुलना में बहुत अधिक सक्रिय है।
गर्भावस्था के दौरान, प्लेसेंटा में एक और गोनैडोट्रोपिक हार्मोन बनता है - कोरियोनिक गोनाडोट्रोपिन (सीजी)। इसका पिट्यूटरी ग्रंथि के गोनैडोट्रोपिक हार्मोन के समान जैविक प्रभाव होता है। गर्भावस्था के दौरान पिट्यूटरी ग्रंथि द्वारा गोनैडोट्रोपिन का स्राव कमजोर हो जाता है।
अंडाशय पर विशिष्ट प्रभाव के अलावा, शरीर में कई प्रक्रियाओं पर गोनैडोट्रोपिक हार्मोन का स्पष्ट प्रभाव पड़ता है। यह पाया गया कि सीजी और एलएच दोनों रक्त की फाइब्रिनोलिटिक गतिविधि को बढ़ाते हैं (Ch. S. Guseynov et al।, 1967)। उत्पादित एल्ब्यूमिन की तैयारी में गोनैडोट्रोपिन की उपस्थिति क्लिनिक में उनके उपयोग को एक प्रतिरक्षाविज्ञानी घटक के साथ एलर्जी और बीमारियों के उपचार के लिए प्रभावी बनाती है।
गोनैडोट्रोपिक हार्मोन की शुरूआत के साथ, तंत्रिका तंत्र के विभिन्न भागों की उत्तेजना बदल जाती है। उनका सकारात्मक ट्रॉफिक प्रभाव होता है और जानवरों में प्रयोगात्मक गैस्ट्रिक अल्सर के उपचार में तेजी लाता है।
LTG (सापेक्ष आणविक भार 24,000-26,000) पिट्यूटरी एसिडोफिल द्वारा बनता है। इन कोशिकाओं के कोशिका द्रव्य में कैरमाइन के साथ लाल रंग के कई दाने होते हैं।
इसकी रासायनिक संरचना के अनुसार, एलटीजी एक साधारण प्रोटीन है। इसका मुख्य जैविक प्रभाव कुछ जानवरों की प्रजातियों और मनुष्यों में स्तनपान के दौरान दूध के गठन को सक्रिय करना है। इसके अलावा, हार्मोन कॉर्पस ल्यूटियम के अंतःस्रावी कार्य का समर्थन करता है।
एंटीगोनैडोट्रोपिन
मानव शरीर में जानवरों के सीरम या पिट्यूटरी ग्रंथि से पृथक गोनैडोट्रोपिक हार्मोन की शुरूआत के साथ, रक्त में विशिष्ट एंटीगोनैडोट्रोपिक एंटीबॉडी दिखाई देते हैं। वे इंजेक्शन हार्मोन के प्रभाव को बेअसर करते हैं।
स्टीवंस और क्रिस्टल (1973) के अध्ययन से पता चला है कि मानव कोरियोनिक गोनाडोट्रोपिन की शुरूआत के साथ भी, शरीर में एंटीबॉडी बनते हैं जो एलएच के साथ प्रतिक्रिया करते हैं। जाहिर है, यह सीजी और एलजी की रासायनिक संरचना की निकटता के कारण है। मूत्र या पिट्यूटरी ऊतक से पृथक अपर्याप्त रूप से शुद्ध की गई तैयारी में, एंटीगोनाडोट्रोपिन भी मौजूद हो सकते हैं (ओ। एन। सवचेंको, 1967)। इन पदार्थों की प्रकृति अभी तक स्पष्ट नहीं हुई है। यह ज्ञात है कि, गोनैडोट्रोपिक हार्मोन के विपरीत, वे ऊष्मीय रूप से स्थिर होते हैं।
सेक्स हार्मोन
तथाकथित निष्पादन हार्मोन जो जननांगों, साथ ही पूरे शरीर को प्रभावित करते हैं, उनमें सेक्स हार्मोन ("प्रजनन हार्मोन") का एक समूह शामिल है। वे अंडाशय में, कम मात्रा में - अधिवृक्क प्रांतस्था में बनते हैं। गर्भावस्था के दौरान, प्लेसेंटा सेक्स हार्मोन का स्रोत है।
उनकी क्रिया और गठन के स्थान के अनुसार, उन्हें विभाजित किया जाता है: एस्ट्रोजेन, जो जानवरों में एस्ट्रस (ओस्ट्रस) या योनि उपकला के केराटिनाइजेशन का कारण बनते हैं; जेनेगेंस, या कॉर्पस ल्यूटियम हार्मोन, जिनमें से मुख्य शारीरिक गुण उन प्रक्रियाओं को प्रोत्साहित करना है जो एक विकासशील अंडे के आरोपण और गर्भावस्था के विकास को सुनिश्चित करते हैं; एण्ड्रोजन, या पुरुष सेक्स हार्मोन जिनका पौरुष प्रभाव होता है।
इन पदार्थों के अलावा, अंडाशय एक और हार्मोन - रिलैक्सिन का उत्पादन करते हैं, जो बच्चे के जन्म के दौरान जघन जोड़ के स्नायुबंधन को शिथिल करता है, साथ ही गर्भाशय ग्रीवा के नरम होने और ग्रीवा नहर के विस्तार का कारण बनता है। हालांकि, शरीर में इस हार्मोन की भूमिका को अच्छी तरह से समझा नहीं गया है।
एस्ट्रोजेन और जेनेजेन महिला सेक्स हार्मोन हैं। उनका मुख्य रूप से प्रजनन तंत्र, साथ ही साथ स्तन ग्रंथियों पर एक विशिष्ट प्रभाव पड़ता है। हार्मोन की क्रिया के प्रति सबसे अधिक संवेदनशील अंग को लक्ष्य अंग कहा जाता है। सेक्स हार्मोन के लिए, लक्ष्य गर्भाशय, योनि, फैलोपियन ट्यूब और अंडाशय हैं। रासायनिक संरचना के अनुसार, रिलैक्सिन को छोड़कर सभी सेक्स हार्मोन स्टेरॉयड हैं। ये ऐसे पदार्थ हैं जिनमें साइक्लोपेंटेनफेनेंथ्रीन की संरचना होती है और सामान्य योजना के अनुसार निर्मित होते हैं। स्टेरॉयड के कंकाल बनाने वाले छल्ले आमतौर पर ए, बी, सी और डी अक्षरों द्वारा दर्शाए जाते हैं।
स्टेरॉयड यौगिकों की श्रृंखला में कार्बन परमाणुओं का क्रमांकन उनके अध्ययन के दौरान ऐतिहासिक रूप से विकसित हुआ है। वलय A, B और D के कार्बन परमाणु घड़ी की दिशा में गिने जाते हैं, वलय C के परमाणु इसकी दिशा में गिने जाते हैं।
एस्ट्रोजेन

ये सबसे महत्वपूर्ण महिला सेक्स हार्मोन हैं। उनमें से ज्यादातर अंडाशय में बनते हैं - अंतरालीय कोशिकाओं और रोम के आंतरिक झिल्ली में। गैर-गर्भवती महिलाओं में, अधिवृक्क प्रांतस्था में एक निश्चित मात्रा में एस्ट्रोजन भी बनता है।
मुख्य एस्ट्रोजेन एस्ट्राडियोल, एस्ट्रोन और एस्ट्रिऑल हैं। इसके अलावा, मानव शरीर के जैविक तरल पदार्थों से कई अन्य एस्ट्रोजेनिक हार्मोन अलग किए गए हैं, जिन्हें तीन मुख्य एस्ट्रोजेन के चयापचय उत्पादों के रूप में माना जाता है।
इन सभी पदार्थों की एक सामान्य संपत्ति जानवरों में एस्ट्रस पैदा करने की क्षमता है। इसलिए, किसी विशेष हार्मोन की गतिविधि का आकलन करते समय, इसकी न्यूनतम मात्रा जो एस्ट्रस का कारण बनती है, को ध्यान में रखा जाता है।
महिला सेक्स हार्मोन की गतिविधि को निर्धारित करने के लिए, एलन और डोज़ी विधि का उपयोग किया जाता है। इसमें अंडाशय के अर्क या अध्ययन किए गए हार्मोनल पदार्थों की विभिन्न मात्रा में कास्टेड जानवरों (चूहों या चूहों) को प्रशासित करना शामिल है, जो उन्हें एस्ट्रस का कारण बनता है। एस्ट्रस के दौरान लिए गए स्वाब में बड़ी संख्या में केराटिनाइजिंग कोशिकाएं होती हैं। किसी पदार्थ की सबसे छोटी मात्रा, जिसके प्रशासन पर 70% प्रायोगिक कास्टेड चूहों में केराटिनाइजिंग कोशिकाओं का पता लगाया जा सकता है, माउस यूनिट कहलाती है।
1939 में हुए एक अंतरराष्ट्रीय समझौते के अनुसार, क्रिस्टलीय एस्ट्रोन को मानक दवा माना जाता है।
I. N. Nazarov और L. D. Bergelson (1955), ने एस्ट्रोजेनिक हार्मोन को चूहों को सूक्ष्म रूप से पेश करते हुए निर्धारित किया कि एस्ट्रोन की सबसे छोटी सक्रिय खुराक 0.7 μg है, एस्ट्राडियो-ला -176 0.1 है, और एस्ट्रिऑल 10 μg है। इसलिए, एलन और डोज़ी परीक्षण के अनुसार, सबसे सक्रिय एस्ट्रोजन एस्ट्राडियोल है, और सबसे कम सक्रिय एस्ट्रिऑल है।
हार्मोन की गतिविधि काफी हद तक प्रशासन की विधि पर निर्भर करती है। तो, एस्ट्रिऑल जब सूक्ष्म रूप से प्रशासित होता है तो कमजोर कार्य करता है, और जब मौखिक रूप से प्रशासित किया जाता है - एस्ट्रोन से अधिक मजबूत होता है।
तीन मुख्य एस्ट्रोजेन की जैविक गतिविधि अलग है और उनमें से प्रत्येक का लक्ष्य अंगों - गर्भाशय और योनि पर एक अलग प्रभाव पड़ता है। इसलिए, यदि एलेन और डोज़ी परीक्षण के अनुसार एस्ट्राडियोल एस्ट्रिऑल और एस्ट्रोन की तुलना में अधिक सक्रिय है, तो एस्ट्रिऑल एक अन्य परीक्षण के अनुसार सबसे अधिक सक्रिय निकला: अपरिपक्व चूहों के गर्भाशय के वजन में वृद्धि। इसलिए, एंडोमेट्रियम एस्ट्राडियोल के प्रति सबसे अधिक संवेदनशील होता है, और गर्भाशय की मांसपेशी एस्ट्रिऑल के प्रति सबसे अधिक संवेदनशील होती है। एस्ट्रिऑल की छोटी खुराक का योनि के ऊतकों और ग्रीवा नहर पर महत्वपूर्ण प्रभाव पड़ता है। इन अंगों के उपकला में इसकी शुरूआत के साथ, एस्ट्रोन और एस्ट्राडियोल की कार्रवाई की तुलना में तटस्थ म्यूकोपॉलीसेकेराइड अधिक तीव्रता से बनते हैं। एंडोमेट्रियम केवल बड़ी मात्रा में एस्ट्रिऑल का जवाब देता है।
वर्तमान में, 100 से अधिक दवाओं को संश्लेषित किया गया है जिन्होंने एस्ट्रोजेनिक गुणों का उच्चारण किया है, लेकिन स्टेरॉयड संरचना नहीं है। इन पदार्थों की एस्ट्रोजेनिक गतिविधि स्टेरॉयड हार्मोन की तुलना में अधिक होती है, इसके अलावा, मौखिक रूप से और पैरेन्टेरली प्रशासित होने पर उनकी क्रिया समान होती है।
स्टेरॉयड और गैर-स्टेरायडल दोनों तरह के सभी एस्ट्रोजेन की मुख्य जैविक संपत्ति, महिला जननांग अंगों पर एक विशिष्ट प्रभाव डालने और माध्यमिक यौन विशेषताओं के विकास को प्रोत्साहित करने की क्षमता है।
एस्ट्रोजेन एंडोमेट्रियम और मायोमेट्रियम के हाइपरट्रॉफी और हाइपरप्लासिया का कारण बनते हैं। इन हार्मोनों का एक भी इंजेक्शन गर्भाशय के जहाजों को प्रभावित करता है, हिस्टामाइन और सेरोटोनिन के स्राव को उत्तेजित करता है, जो गर्भाशय केशिकाओं की पारगम्यता को बढ़ाता है, जिससे ऊतकों में सोडियम और पानी की अवधारण होती है। एस्ट्रोजन के प्रभाव में गर्भाशय ग्रीवा का बेलनाकार उपकला बहु-स्तरित हो जाता है, ट्यूबलर ग्रंथियों का उपकला कम चिपचिपाहट के श्लेष्म स्राव को स्रावित करना शुरू कर देता है, जिसके परिणामस्वरूप, एस्ट्रोजन स्राव में वृद्धि के साथ, शुक्राणु के पारित होने में गर्भाशय गुहा की सुविधा है।
एस्ट्रोजेन के प्रभाव में, योनि के उपकला में भी विशिष्ट परिवर्तन होते हैं। कोशिकाओं की परतें मोटी हो जाती हैं, उनमें ग्लाइकोजन जमा हो जाता है, जो डेडरलीन स्टिक्स के प्रजनन में योगदान देता है।
एस्ट्रोजेन स्तन ग्रंथियों के उत्सर्जन प्रणाली के विकास के साथ-साथ ग्रंथि के स्ट्रोमा के अतिवृद्धि में योगदान करते हैं। स्तन कैंसर की घटना पर एस्ट्रोजेन के प्रभाव का सवाल काफी दिलचस्पी का है। यद्यपि पशु प्रयोगों ने प्रशासित एस्ट्रोजन की खुराक पर कैंसर के विकास की सख्त निर्भरता नहीं दिखाई है, एस्ट्रोजेन की सामग्री में वृद्धि (कूप, डिम्बग्रंथि ट्यूमर, आदि की दृढ़ता) के बीच संबंध के विकास के साथ सिद्ध हुआ है। सिस्टिक रेशेदार मास्टोपाथी। एस्ट्रोजेन के प्रभाव में स्तन ग्रंथियों के उपकला की माइटोटिक गतिविधि में वृद्धि का स्पष्ट रूप से प्रदर्शन किया गया है (एस.एस. लागुचेव, 1970)।
एस्ट्रोजेन की बड़ी खुराक की शुरूआत, साथ ही परिधीय अंतःस्रावी ग्रंथियों द्वारा उत्पादित अन्य हार्मोन, पिट्यूटरी और हाइपोथैलेमस के ट्रिगर हार्मोन के स्राव को रोकता है, जो सीधे एस्ट्रोजन - एफएसएच और एलएच के उत्पादन से संबंधित है।
एस्ट्रोजेन हार्मोन न केवल लक्षित अंगों को प्रभावित करते हैं, बल्कि पूरे शरीर को भी प्रभावित करते हैं, हार्मोन थेरेपी निर्धारित करते समय इसे ध्यान में रखा जाना चाहिए।
एस्ट्रोजेन के प्रभाव में, शरीर में सोडियम, पानी और नाइट्रोजन बरकरार रहता है। यह आमतौर पर डायरिया को कम करता है।
लिपिड चयापचय पर एस्ट्रोजेन का प्रभाव स्पष्ट रूप से व्यक्त किया गया है। डिम्बग्रंथि समारोह और एथेरोस्क्लेरोसिस की घटना के बीच एक संबंध है। अंडाशय को हटाते समय, क्लिनिक और प्रयोग दोनों में, रक्त में कोलेस्ट्रॉल की मात्रा में वृद्धि देखी जाती है। इसलिए, एथेरोस्क्लेरोसिस के उपचार में एस्ट्रोजेन का उपयोग किया जाता है।
एस्ट्रोजेन की शारीरिक खुराक रेटिकुलोएन्डोथेलियल सिस्टम के कार्य को उत्तेजित करती है, एंटीबॉडी के उत्पादन और फागोसाइट्स की गतिविधि को बढ़ाती है। नतीजतन, संक्रमण के लिए शरीर की प्रतिरोधक क्षमता बढ़ जाती है।
एस्ट्रोजेन के एक इंजेक्शन के बाद, मस्तिष्क वाहिकाओं का विस्तार होता है, संभवतः एसिटाइलकोलाइन की रिहाई के कारण। यह भी पाया गया (गुड्रिच, वुड, 1966) कि एस्ट्राडियोल परिधीय नसों की लोच को बढ़ाता है। इससे उनमें रक्त प्रवाह की दर कम हो जाती है। लंबे समय तक एस्ट्रोजन का प्रशासन, इसके विपरीत, रक्तचाप बढ़ाता है। हेमटोपोइजिस पर एस्ट्रोजेन का एक निश्चित प्रभाव पड़ता है। यह पुरुषों की तुलना में महिलाओं में लाल रक्त कोशिकाओं की कम संख्या की व्याख्या करता है (एस। आई। रयाबोव, 1963)।
एस्ट्रोजेन कुछ हद तक शरीर की ऊंचाई और वजन निर्धारित करते हैं। कोशिका विभाजन के नियमन में एस्ट्रोजेन की महत्वपूर्ण भूमिका मानते हैं, हालांकि, इस मुद्दे पर डेटा विरोधाभासी हैं। यह ज्ञात है कि एस्ट्रोजेन की बड़ी खुराक की शुरूआत के साथ, शरीर में प्रसार के फॉसी दिखाई देते हैं, कभी-कभी एक ब्लास्टोमेटस चरित्र प्राप्त करते हैं। दूसरी ओर, नियोप्लाज्म के विकास पर एस्ट्रोजेन के निरोधात्मक प्रभाव के आंकड़े हैं, विशेष रूप से, प्रोस्टेट ट्यूमर के विकास पर। हर्ट्ज़ (1967) ने कैंसर के एटियलजि और रोगजनन में स्टेरॉयड हार्मोन की भूमिका पर सामग्री की समीक्षा में निष्कर्ष निकाला कि नैदानिक अध्ययन एस्ट्रोजेन की नियोप्लाज्म पैदा करने की क्षमता को साबित नहीं कर सके।
एस्ट्रोजेन लगभग सभी अंतःस्रावी अंगों को प्रभावित करते हैं। उनका प्रभाव काफी हद तक खुराक पर निर्भर करता है। तो, छोटी और मध्यम खुराक अंडाशय के विकास और रोम की परिपक्वता को प्रोत्साहित करती है, बड़े वाले ओव्यूलेशन को दबाते हैं और रोम की दृढ़ता की ओर ले जाते हैं, और बहुत बड़ी खुराक अंडाशय में एट्रोफिक प्रक्रियाओं का कारण बनती है (वी। ई। लिव्रैंड, वी। ए। कास्क, 1973)। एस्ट्रोजेन का पूर्वकाल पिट्यूटरी ग्रंथि (एडेनोहाइपोफिसिस) पर बहुत प्रभाव पड़ता है। उनमें से छोटी मात्रा ग्रंथि में हार्मोन के गठन को उत्तेजित करती है, जबकि बड़ी मात्रा में, इसके विपरीत, इसकी गतिविधि को रोकती है। एस्ट्रोजन हार्मोन ग्रोथ हार्मोन के निर्माण को रोकते हैं। यौवन और प्रीपुबर्टल उम्र के रोगियों को एस्ट्रोजेनिक दवाओं को निर्धारित करते समय इस परिस्थिति को ध्यान में रखा जाना चाहिए।
एस्ट्रोजेन का प्रभाव थायरॉयड ग्रंथि के कार्य को भी प्रभावित करता है। यद्यपि इस प्रभाव की प्रकृति पर डेटा विरोधाभासी हैं, अधिकांश लेखक हार्मोन की छोटी खुराक के उत्तेजक प्रभाव और बड़ी खुराक के अवरुद्ध प्रभाव (एन.के. ग्रिडनेवा, एन.जी. डोरोशेवा, 1973) पर ध्यान देते हैं।
एस्ट्रोजेन अधिवृक्क प्रांतस्था को उत्तेजित करते हैं: उनके प्रभाव में, अधिवृक्क ग्रंथियों का द्रव्यमान बधिया के बाद बढ़ जाता है और रक्त में कॉर्टिकोस्टेरॉइड की सामग्री बढ़ जाती है। एस्ट्रोजेन के प्रभाव में, थाइमस का शोष होता है।
यद्यपि अंडाशय और गैर-स्टेरायडल एस्ट्रोजेन द्वारा उत्पादित एस्ट्रोजेन का लक्ष्य अंगों और शरीर दोनों पर प्रभाव समान है, कुछ अंतर हैं जिन्हें तर्कसंगत हार्मोनल थेरेपी चुनते समय विचार किया जाना चाहिए। तो, स्टेरॉयड दवाओं का हल्का प्रभाव होता है और कम दुष्प्रभाव होते हैं। जाहिर है, यह इस तथ्य के कारण है कि जिगर में निष्क्रिय होने के कारण प्राकृतिक एस्ट्रोजेन शरीर से अधिक तेज़ी से उत्सर्जित होते हैं। इसके अलावा, गैर-स्टेरायडल एस्ट्रोजेन का यकृत कोशिकाओं पर अधिक स्पष्ट प्रभाव पड़ता है, इसलिए यदि इसका कार्य बिगड़ा हुआ है, तो उनका उपयोग सीमित होना चाहिए।
एंटीएस्ट्रोजेन. ऐसे कई पदार्थ हैं जिनकी जननांगों पर क्रिया एस्ट्रोजेन की क्रिया के विपरीत होती है, अर्थात वे उनके विरोधी होते हैं। इन पदार्थों को तीन समूहों में विभाजित किया जा सकता है: एण्ड्रोजन का प्रकार, जो गर्भाशय के विकास को रोकता है और अंडाशय के वजन को कम करता है (इस समूह में अधिवृक्क प्रांतस्था के हार्मोन भी शामिल हैं, जिनका एक समान प्रभाव होता है); सिनेस्ट्रोल जैसे सिंथेटिक एस्ट्रोजेन की संरचना में समान पदार्थ, जिनका कमजोर एस्ट्रोजेनिक प्रभाव होता है, लेकिन शरीर में उत्पादित मजबूत एस्ट्रोजेन (डाइमिथाइलस्टिल-बेस्ट्रोल, फ़्लोरेटिन, आदि) के प्रभाव को दबाते हैं; पदार्थ जो स्टेरॉयड नहीं हैं और सिंथेटिक एस्ट्रोजेन के साथ संरचनात्मक समानता नहीं रखते हैं।
गेस्टेजेन्स

एस्ट्रोजेन की तरह, वे महिला सेक्स हार्मोन हैं। मुख्य एक प्रोजेस्टेरोन है। यह अंडाशय के कॉर्पस ल्यूटियम, साथ ही प्लेसेंटा और एड्रेनल कॉर्टेक्स में संश्लेषित होता है। कॉर्पस ल्यूटियम भी 17-हाइड्रॉक्सीप्रोजेस्टेरोन का उत्पादन करता है।
एस्ट्रोजन की तरह, इसका मुख्य रूप से जननांगों पर एक विशिष्ट प्रभाव पड़ता है। प्रोजेस्टेरोन के कुछ प्रभाव एस्ट्रोजन के विपरीत होते हैं। निषेचन के मामले में, यह हार्मोन ओव्यूलेशन को दबा देता है, भ्रूण के विकास के लिए आवश्यक गर्भाशय में स्थितियों को बनाए रखता है, और इसके संकुचन को रोकता है। एस्ट्रोजेन के कारण योनि उपकला के केराटिनाइजेशन के दमन में प्रोजेस्टेरोन का विरोधी प्रभाव भी प्रकट होता है। प्रोजेस्टेरोन की बड़ी खुराक एंडोमेट्रियम पर एस्ट्रोजेन के प्रजनन प्रभाव को कम करती है।
हालांकि, एस्ट्रोजन और प्रोजेस्टेरोन के बीच संबंध विरोधी की तुलना में बहुत अधिक जटिल है। अक्सर ये हार्मोन सहक्रियात्मक होते हैं। ज्यादातर मामलों में प्रोजेस्टेरोन की जैविक क्रिया एस्ट्रोजन उत्तेजना के बाद होती है। उनके साथ, जेस्टजेन स्तन ग्रंथियों में परिवर्तन का कारण बनते हैं: यदि एस्ट्रोजेन नलिकाओं को लंबा और मोटा करते हैं, तो प्रोजेस्टेरोन एल्वियोली के विकास को बढ़ाता है। गर्भाशय पर जेनेजन की कार्रवाई के तहत, पहले एस्ट्रोजेन द्वारा उत्तेजित, एंडोमेट्रियल ग्रंथियों के विकास और स्राव को नोट किया गया था; स्ट्रोमा की कोशिकाओं में परिवर्तन होते हैं - नाभिक का आकार बढ़ता है, कुछ एंजाइमों की सामग्री, ग्लाइकोप्रोटीन बढ़ जाती है। गर्भावस्था को बनाए रखने के लिए प्रोजेस्टेरोन आवश्यक है, लेकिन कॉर्पस ल्यूटियम को हटाने से गर्भावस्था केवल प्रारंभिक अवस्था में ही समाप्त हो जाती है। बाद में, प्लेसेंटा में प्रोजेस्टेरोन का उत्पादन होता है।
लक्षित अंगों पर विशिष्ट प्रभाव के अलावा, जेनेजेन्स शरीर में होने वाली कई प्रक्रियाओं को प्रभावित करते हैं। तो, प्रोजेस्टेरोन पानी और लवण को बरकरार रखता है, मूत्र में नाइट्रोजन सामग्री को बढ़ाता है; शरीर के तापमान को बढ़ाता है, जो एक निषेचित अंडे के विकास के लिए अनुकूलतम स्थिति बनाता है; इसका सीधा शामक है, और बड़ी खुराक में, एक मादक प्रभाव है।
क्लिनिक और प्रायोगिक उच्च रक्तचाप (आर्मस्ट्रांग, 1959) दोनों में जेस्टजेन्स के काल्पनिक प्रभाव का वर्णन किया गया है। गेस्टाजेन गैस्ट्रिक जूस के स्राव को बढ़ाते हैं और पित्त स्राव को रोकते हैं।
एस्ट्रोजेन जैसे अंतःस्रावी अंगों पर प्रोजेस्टेरोन की क्रिया खुराक पर निर्भर करती है। तो, इसकी थोड़ी मात्रा पिट्यूटरी ग्रंथि की गतिविधि को उत्तेजित करती है, गोनैडोट्रोपिक हार्मोन के स्राव को बढ़ाती है, और बड़ी मात्रा में उनके उत्पादन को अवरुद्ध करती है, जिससे कूप और ओव्यूलेशन की परिपक्वता को रोका जा सकता है।
गर्भ निरोधक प्रभाव पैदा करने वाले ओव्यूलेशन को बाधित करने के लिए जेनेजेन्स की संपत्ति 1921 में हैबरलैंड द्वारा स्थापित की गई थी। उन्होंने जानवरों में अस्थायी बांझपन की खोज की जब उन्हें कॉर्पस ल्यूटियम या प्लेसेंटल ऊतक के साथ प्रत्यारोपित किया गया था।
एंटीगोनैडोट्रोपिक क्रिया के अलावा, प्रोजेस्टेरोन सीधे अंडाशय को प्रभावित करता है, इसके आकार को कम करता है और रोम के विकास को रोकता है। शरीर में लंबे समय तक जेनेजेन्स का प्रशासन अधिवृक्क ग्रंथियों के कार्य में कमी की ओर जाता है।
थायरॉइड ग्रंथि को प्रभावित करते हुए, जेनेजेन्स प्रोटीन-बाध्य आयोडीन की मात्रा में वृद्धि और ग्लोब्युलिन की थायरोक्सिन-बाध्यकारी क्षमता में वृद्धि का कारण बनते हैं।
वर्तमान में, प्रोजेस्टेरोन के प्रभाव से अधिक मजबूत प्रोजेस्टेशनल प्रभाव वाली स्टेरॉयड दवाओं की एक महत्वपूर्ण संख्या को संश्लेषित किया गया है: क्लोरमैडिनोन एसीटेट, सबसे शक्तिशाली प्रोजेस्टोजन, जिसमें प्रोजेस्टेरोन की तुलना में 100 गुना अधिक गतिविधि होती है, और गोनैडोट्रोपिक फ़ंक्शन पर बहुत कम प्रभाव पड़ता है। पिट्यूटरी ग्रंथि के; मेड्रोक्सी-प्रोजेस्टेरोन एसीटेट - प्रजनन तंत्र पर कार्रवाई के मामले में प्रोजेस्टेरोन से 15 गुना अधिक सक्रिय और एंटीगोनैडोट्रोपिक क्रिया आदि के मामले में 80 गुना अधिक सक्रिय।
एण्ड्रोजन

एण्ड्रोजन पुरुष सेक्स हार्मोन हैं। वे नर और मादा दोनों शरीरों में उत्पन्न होते हैं। महिलाओं में, वे मुख्य रूप से अधिवृक्क प्रांतस्था के जालीदार क्षेत्र में संश्लेषित होते हैं। इन हार्मोनों की थोड़ी मात्रा अंडाशय में भी उत्पन्न होती है। कुछ रोग स्थितियों में एण्ड्रोजन का डिम्बग्रंथि स्राव तेजी से बढ़ता है - पॉलीसिस्टिक अंडाशय और विशेष रूप से एरेनोब्लास्टोमा (केडी स्मिरनोवा, 1969)। अंडाशय मुख्य रूप से androstenedione, टेस्टोस्टेरोन और एपिटेस्टोस्टेरोन का उत्पादन करते हैं। ट्यूमर में अंतिम दो हार्मोन महत्वपूर्ण मात्रा में संश्लेषित होते हैं। एण्ड्रोजन की जैविक गतिविधि अलग है। 100 माइक्रोग्राम एंड्रोस्टेरोन की गतिविधि, जो 15 माइक्रोग्राम टेस्टोस्टेरोन की गतिविधि के बराबर है, को उनकी जैविक गतिविधि की एक अंतरराष्ट्रीय इकाई के रूप में लिया जाता है। सभी सेक्स हार्मोन की तरह, एण्ड्रोजन मुख्य रूप से जननांग अंगों को प्रभावित करते हैं और उनका प्रभाव खुराक पर निर्भर होता है।
एण्ड्रोजन भगशेफ के विकास को उत्तेजित करते हैं, लेबिया मेजा की अतिवृद्धि और नाबालिगों के शोष का कारण बनते हैं, और गर्भाशय और योनि को भी प्रभावित करते हैं।
यह विशेषता है कि गर्भाशय पर एण्ड्रोजन का प्रभाव केवल कामकाजी अंडाशय वाली महिलाओं में होता है, अर्थात एक निश्चित एस्ट्रोजन संतृप्ति की पृष्ठभूमि के खिलाफ। इसी समय, एंड्रोजेनिक हार्मोन की छोटी खुराक एंडोमेट्रियम में पूर्वगामी परिवर्तन का कारण बनती है, और बड़ी खुराक शोष का कारण बनती है। मायोमेट्रियम में, बड़ी खुराक की शुरूआत के साथ, रक्त प्रवाह की गति कम हो जाती है, फाइब्रोसिस और सिस्टिक-ग्लैंडुलर हाइपरप्लासिया विकसित होते हैं।
योनि पर, एण्ड्रोजन का जेस्टेन के समान प्रभाव होता है, अर्थात, वे एस्ट्रोजेनिक हार्मोन के कारण श्लेष्म झिल्ली के प्रसार को रोकते हैं। जब अंडाशय का कार्य बंद हो जाता है, तो बड़ी मात्रा में प्रशासित एण्ड्रोजन योनि म्यूकोसा के कुछ प्रसार का कारण बनते हैं। जाहिर है, जेनेजेन की तरह, एण्ड्रोजन एक सहक्रियात्मक के रूप में या खुराक के आधार पर एस्ट्रोजन हार्मोन के विरोधी के रूप में कार्य कर सकते हैं। तो, एण्ड्रोजन की थोड़ी मात्रा बधिया पशुओं के गर्भाशय और योनि पर एस्ट्रोजेन के प्रभाव को बढ़ाती है, और बड़ी खुराक, इसके विपरीत, एस्ट्रोजन हार्मोन के प्रभाव को कम करती है।
एण्ड्रोजन स्तन ग्रंथि में दूध के निर्माण को रोकते हैं, नर्सिंग माताओं में इसके स्राव को रोकते हैं। एण्ड्रोजन की छोटी खुराक पिट्यूटरी ग्रंथि द्वारा गोनैडोट्रोपिक हार्मोन के उत्पादन को उत्तेजित करती है, जो बदले में अंडाशय में रोम की परिपक्वता को सक्रिय करती है, और बड़ी खुराक पिट्यूटरी ग्रंथि के कार्य को अवरुद्ध करती है। इस प्रभाव ने स्तन कैंसर के उपचार में अपना आवेदन पाया है, जब टेस्टोस्टेरोन की बड़ी खुराक पिट्यूटरी ग्रंथि से गोनैडोट्रोपिक हार्मोन के स्राव में कमी और अंडाशय में एट्रोफिक परिवर्तन का कारण बनती है (हां एम। ब्रुस्किन,
1969).
एण्ड्रोजन का अधिवृक्क ग्रंथियों पर स्पष्ट प्रभाव पड़ता है। कई लेखकों द्वारा किए गए प्रायोगिक अध्ययनों से पता चला है कि लंबे समय तक टेस्टोस्टेरोन का प्रशासन अधिवृक्क प्रांतस्था (एमसी कार्टी एट अल।, 1966; टेलीग्री एट अल।, 1967) के कार्य में कमी की ओर जाता है। बी। वी। एपशेटिन (1968), डी। ई। यांकेलविच और एम। 3. युरचेंको (1969) ने क्लिनिक में एंड्रोजेनिक दवाओं का उपयोग करते समय अधिवृक्क प्रांतस्था के कार्य के दमन को देखा।
जाहिर है, अधिवृक्क ग्रंथियों की कार्यात्मक स्थिति पर एण्ड्रोजन का प्रभाव भी खुराक पर निर्भर करता है। आई.एन. एफिमोव (1968), रॉय एट अल (1969) के अनुसार, इन हार्मोनों की छोटी खुराक अधिवृक्क ग्रंथियों के कार्य को कम करती है, और बड़ी मात्रा में इसे उत्तेजित करती है। उसी समय, किटय एट अल (1966) विपरीत परिणामों की रिपोर्ट करते हैं।
एण्ड्रोजन अग्न्याशय के लैंगरहैंस के आइलेट्स के कार्य को उत्तेजित करते हैं, जिसमें एक निश्चित एंटीडायबिटिक प्रभाव होता है।
महिलाएं आमतौर पर पुरुषों की तुलना में कम एण्ड्रोजन का उत्पादन करती हैं। हालांकि, हार्मोनल रूप से सक्रिय ट्यूमर के साथ-साथ पॉलीसिस्टिक () के साथ, अंडाशय बड़ी मात्रा में एंड्रोजेनिक यौगिकों का उत्पादन कर सकते हैं, जो महिलाओं में माध्यमिक पुरुष यौन विशेषताओं की उपस्थिति की ओर जाता है।
महिलाओं के अधिवृक्क प्रांतस्था द्वारा संश्लेषित एण्ड्रोजन के लिए भी यही नोट किया जा सकता है। इसलिए, यदि सामान्य रूप से एंड्रोजेनिक हार्मोन डिहाइड्रोएपियनड्रोस्टेरोन की एक छोटी मात्रा अधिवृक्क प्रांतस्था के जालीदार क्षेत्र में बनती है, तो अधिवृक्क ग्रंथि के हाइपरफंक्शन के साथ, और इससे भी अधिक इसके ट्यूमर के साथ, बहुत सारे एण्ड्रोजन निकलते हैं, जो पौरुष का कारण बनता है।
जननांग अंगों पर एक स्पष्ट प्रभाव के अलावा, एण्ड्रोजन प्रोटीन, वसा और खनिज चयापचय के नियमन में शामिल होते हैं।
विशेष रूप से संकेतक प्रोटीन संश्लेषण पर एण्ड्रोजन का उत्तेजक प्रभाव है। यह तथाकथित उपचय प्रभाव राइबोसोमल आरएनए पर प्रोटीन संश्लेषण में वृद्धि के कारण होता है, जिससे नाइट्रोजन प्रतिधारण होता है। प्रोटीन संश्लेषण में वृद्धि मांसपेशियों के ऊतकों में सबसे अधिक तीव्रता से होती है। एण्ड्रोजन का यह उपचय प्रभाव महिलाओं की तुलना में पुरुषों में मजबूत मांसपेशियों के विकास की व्याख्या करता है (ज़चमन एट अल।, 1966)।
शरीर में नाइट्रोजन प्रतिधारण के अलावा, एण्ड्रोजन फॉस्फोरस और पोटेशियम के संचय का कारण बनते हैं, जो ऊतक प्रोटीन के घटक होते हैं, साथ ही साथ सोडियम और क्लोरीन की अवधारण, और यूरिया के उत्सर्जन को कम करते हैं।
एण्ड्रोजन हड्डी के विकास और एपिफेसील कार्टिलेज के ossification में तेजी लाते हैं। उनका हेमटोपोइजिस पर भी प्रभाव पड़ता है, जिससे लाल रक्त कोशिकाओं और हीमोग्लोबिन की संख्या बढ़ जाती है।
प्रोटीन संश्लेषण को बढ़ाने के लिए एण्ड्रोजन की संपत्ति एनाबॉलिक स्टेरॉयड हार्मोन के एक पूरे समूह के निर्माण का कारण थी। इस तरह के पदार्थों का व्यापक रूप से क्लिनिक में सर्जिकल हस्तक्षेप के बाद रोगियों के इलाज के लिए उपयोग किया जाता है, कुपोषण, आदि के साथ स्पष्ट एंड्रोजेनिक और मजबूत उपचय क्रिया। इस तरह के हार्मोन 1/-एथिल-19-नॉर्टेस्टोस्टेरोन (नीलेवर, नोरेथन-ड्रोलोन) हैं, जिसमें टेस्टोस्टेरोन (छवि 12), नेरोबोल (डायनाबोल), नेरोबोलिल (ड्यूराबोलिन), रेटाबोलिल नॉरबोलेटन, ऑक्सेंड्रोलोन, आदि की तुलना में 16 गुना कम एंड्रोजेनिक गतिविधि है। .
एंटीएंड्रोजेन्स. उनका उपयोग मुँहासे वल्गरिस, हिर्सुटिज़्म, लड़कियों में आदि के इलाज के लिए किया जाता है। हैमरस्टीन (1973) अत्यधिक प्रभावी एंटीएंड्रोजेनिक दवाओं में से एक का वर्णन करता है - साइप्रोटेरोन एसीटेट, जिसमें एंटीएंड्रोजेनिक कार्रवाई के अलावा, गर्भनिरोधक गुण भी होते हैं। इसके उपयोग से रक्त प्लाज्मा में प्रोजेस्टेरोन की मात्रा में तेज कमी आती है।
स्टेरॉयड हार्मोन की क्रिया का तंत्र
इस तथ्य के बावजूद कि चयापचय के विभिन्न पहलुओं पर स्टेरॉयड हार्मोन का प्रभाव सर्वविदित है, सेलुलर और आणविक स्तर पर उनकी क्रिया के तंत्र को अच्छी तरह से समझा नहीं गया है। स्टेरॉयड हार्मोन के भौतिक गुणों के अध्ययन में उनकी रासायनिक संरचना के संबंध में अध्ययन करने में इस दिशा में सफलता प्राप्त हुई है।
इसलिए, यदि हम एक पेपर शीट के तल में स्थित एक स्टेरॉयड अणु की कल्पना करते हैं, तो कोणीय मिथाइल समूह इस विमान के ऊपर रखे जाते हैं। एक ही दिशा में प्रक्षेपित समूहों को "सीआईएस" कहा जाता है और जो विपरीत दिशा में प्रक्षेपित होते हैं उन्हें "ट्रांस" कहा जाता है। संरचनात्मक सूत्र लिखते समय, इन अनुमानों को क्रमशः ठोस और बिंदीदार रेखाओं द्वारा दर्शाया जाता है। ये स्थानिक अंतर स्टेरॉयड अणुओं को विभिन्न रासायनिक और जैविक गुण देते हैं।
चूंकि स्टेरॉयड अणु की स्थानिक व्यवस्था में परिवर्तन से जैविक गतिविधि में परिवर्तन होता है, इसलिए यह निष्कर्ष निकालना स्वाभाविक है कि स्टेरॉयड की औषधीय क्रिया उनकी रासायनिक संरचना से निकटता से संबंधित है। शरीर पर इन हार्मोनों के प्रभावों की विविधता, जाहिरा तौर पर, कोशिकाओं में उनकी क्रिया के सामान्य तंत्र की उपस्थिति के कारण संभव है। इन तंत्रों को समझना स्टेरॉयड के कारण होने वाली प्राथमिक औषधीय प्रतिक्रिया का सार है।
हालांकि, विभिन्न अंगों पर हार्मोन की कार्रवाई की चयनात्मकता उनकी रासायनिक संरचना पर निर्भर नहीं करती है। रक्त में घूमते समय, वे सभी अंगों और ऊतकों की कोशिकाओं तक पहुंचते हैं, और केवल कुछ लक्षित अंगों में जमा होते हैं, जिनमें कोशिकाओं में विशेष प्रोटीन पदार्थ होते हैं - रिसेप्टर्स जो हार्मोन के साथ रासायनिक बंधन में प्रवेश करते हैं। वर्तमान में, उनके आणविक भार और अन्य विशेषताओं का अध्ययन किया गया है, साथ ही सेल में रिसेप्टर अणुओं की संख्या और स्टेरॉयड के साथ उनकी बातचीत सुनिश्चित करने वाले बांडों की क्षमता की गणना की गई है। तो, गर्भाशय के उपकला की एक कोशिका में 2000-2500 रिसेप्टर्स होते हैं जो एस्ट्राडियोल को बांधते हैं।
इस प्रकार, एक कोशिका में एक रिसेप्टर अणु के साथ एक स्टेरॉयड हार्मोन की बातचीत अंगों और ऊतकों में बाद के जटिल जैव रासायनिक परिवर्तनों के आणविक तंत्र के लिए स्थितियों में से एक है।
कोशिका पर स्टेरॉयड की क्रिया के संभावित तंत्र के बारे में कई धारणाएँ हैं (AM Utevsky, 1965): हार्मोन कोशिका की सतह पर कार्य करते हैं, इसकी झिल्ली की पारगम्यता को बदलते हैं; एंजाइमेटिक सिस्टम के साथ बातचीत; जीन की गतिविधि को नियंत्रित करें।
चूंकि कोशिका झिल्लियों के कार्य इन झिल्लियों में "एम्बेडेड" एंजाइमों की क्रिया के साथ अटूट रूप से जुड़े हुए हैं, और आनुवंशिक सूचना का तंत्र "एक जीन - एक एंजाइम" के सिद्धांत के अनुसार कार्य करता है, जब कार्रवाई के आवेदन के बिंदुओं का विश्लेषण करते हैं कोई भी स्टेरॉयड हार्मोन, पृथक एंजाइमों पर उनका प्रभाव सामने आता है और एंजाइमेटिक सिस्टम।
इस दृष्टिकोण से, एस्ट्रोजेन की क्रिया के तंत्र का सबसे अच्छा अध्ययन किया जाता है (गोर्स्की एट अल।, 1965; ओ। आई। एपिफानोवा, 1965; पी। वी। सर्गेव, आर। डी। सीफुल्ला, ए। आई। मैस्की, 1971; एस। एस। लागुचेव, 1975)। गोर्स्की और उनके सहयोगियों के अनुसार, लक्ष्य अंगों के साथ एस्ट्रोजेन की आणविक बातचीत तीन चरणों में होती है, और कोशिका के आनुवंशिक तंत्र पर उनका प्रभाव कार्रवाई का एक बाद का प्रभाव है। सबसे पहले, एस्ट्रोजन अणु कोशिका में रिसेप्टर अणु को विशेष रूप से बांधता है, फिर रिसेप्टर अणु की जैविक गतिविधि बदल जाती है और अंतिम चरण में, आरएनए, ग्लूकोज, फॉस्फोलिपिड और प्रोटीन का संश्लेषण बढ़ जाता है।
कई हार्मोन, और मुख्य रूप से हार्मोन (पिट्यूटरी और हाइपोथैलेमस के हार्मोन) को ट्रिगर करते हैं, कोशिका पर अभिनय करते हुए, कोशिका झिल्ली में स्थानीयकृत एडेनिलसाइक्लेज एंजाइम को सक्रिय करते हैं, जो प्रत्येक हार्मोन के लिए विशिष्ट रिसेप्टर से जुड़ा होता है। यह चक्रीय 3", 5" -एडेनोसिन मोनोफॉस्फोरिक एसिड (3", 5 "-एएमपी) की मात्रा को बढ़ाता या घटाता है, जो बदले में इंट्रासेल्युलर तत्वों को सक्रिय करता है।
इस प्रकार, 3",5" -एएमपी, जैसा कि यह था, एक इंट्रासेल्युलर मध्यस्थ है जो इंट्रासेल्युलर एंजाइमेटिक सिस्टम पर हार्मोन के प्रभाव के हस्तांतरण को सुनिश्चित करता है। इस बात के प्रमाण हैं कि स्टेरॉयड हार्मोन परोक्ष रूप से 3",5" -एएमपी के माध्यम से भी कार्य करते हैं।
सेक्स स्टेरॉयड हार्मोन के जैवसंश्लेषण में सामान्य विशेषताएं हैं, और इसके प्रारंभिक चरण, अंडाशय और अधिवृक्क ग्रंथियों और वृषण दोनों में होते हैं, समान होते हैं।
गर्भावस्था, जिसमें कमजोर हार्मोनल गतिविधि है, आधुनिक अवधारणाओं के अनुसार, मुख्य पदार्थ है जिससे हार्मोन बाद में विभिन्न अंतःस्रावी अंगों में बनते हैं। इस क्रम में, प्रेग्नेंसीलोन को अधिवृक्क ग्रंथियों, वृषण, रोम, कॉर्पस ल्यूटियम और डिम्बग्रंथि स्ट्रोमा (हॉल, कोरिट्ज़, 1964; रयान, स्मिथ, 1965; रयान, पेट्रो, 1966) में संश्लेषित किया जाता है। कोलेस्ट्रॉल को प्रेग्नेंसी में बदलने के ये कदम विशेष रुचि के हैं क्योंकि उनके स्तर पर ल्यूटिनाइजिंग हार्मोन की क्रिया (रयान, 1969)।
एसीटेट का कोलेस्ट्रॉल में रूपांतरण कोशिकाओं के घुलनशील और माइक्रोसोमल अंशों में होता है, और कोलेस्ट्रॉल का माइटोकॉन्ड्रियल अंशों में गर्भधारण करने के लिए होता है।
गेस्टाजेन्स का गठन
प्रेग्नेंसीलोन का प्रोजेस्टेरोन में रूपांतरण स्टेरॉयड को संश्लेषित करने वाले सभी अंतःस्रावी अंगों में भी किया जा सकता है, हालांकि, एंजाइमैटिक सिस्टम की विशिष्टता के कारण, यह कॉर्पस ल्यूटियम और आंशिक रूप से रोम में प्रबल होता है। प्रोजेस्टेरोन अपरिवर्तित स्रावित होता है या, मेटाबोलाइट के 20a-हाइड्रॉक्सिल समूह में प्रोजेस्टेरोन के 20-कीटोन की कमी के कारण, यह एक अन्य सक्रिय प्रोजेस्टोजेन में बदल जाता है - 20a-oxypregn-4-en-3-one (Dorfman, Ungar, 1965) )
प्रेग्नेंसी का आगे का परिवर्तन प्रोजेस्टेरोन और एंड्रोजेनिक हार्मोन दोनों के माध्यम से हो सकता है, जिसे नीचे दिए गए चित्र (रयान, 1961 के अनुसार) द्वारा दर्शाया गया है।
एण्ड्रोजन का निर्माण मुख्य रूप से वृषण में होता है, लेकिन अधिवृक्क ग्रंथियों, रोम, कॉर्पस ल्यूटियम, या डिम्बग्रंथि स्ट्रोमा में प्रेग्नेंटोलोन या प्रोजेस्टेरोन (डॉर्फमैन, 1962; रयान, 1965, 1969) के 17-हाइड्रॉक्सिलेशन द्वारा होता है।
17-हाइड्रॉक्सी यौगिकों के निर्माण के लिए प्रतिक्रियाएं कोशिकाओं के माइक्रोसोमल अंश में होती हैं, जबकि डिहाइड्रोजनेज प्रतिक्रिया, जिसमें टेस्टोस्टेरोन और androstenedione का रूपांतरण शामिल है, एक घुलनशील एंजाइम प्रणाली में होता है।
संश्लेषित androstenedione अंडाशय द्वारा स्रावित होता है, जो स्पष्ट रूप से महिलाओं के रक्त में इस स्टेरॉयड का मुख्य स्रोत है।
एस्ट्रोजन गठन
एरोमाटाइजेशन रिएक्शन (स्टेरॉयड रिंग ए में तीन असंतृप्त बंधों का निर्माण) के दौरान एस्ट्रोजेन का निर्माण androstenedione या टेस्टोस्टेरोन से होता है, जो माइक्रोसोमल सेल फ्रैक्शंस (रयान, 1963) में होता है। यह प्रतिक्रिया अंडाशय के स्ट्रोमा, कॉर्टिकल परत, हिलस और ग्रैनुलोसा कोशिकाओं में, कूप में, कॉर्पस ल्यूटियम में और अधिवृक्क ग्रंथियों और वृषण में एक निश्चित मात्रा में भी हो सकती है।
एस्ट्रोजेन के जैवसंश्लेषण के लिए कई रास्ते हैं। तो, एस्ट्राडियोल टेस्टोस्टेरोन से बनाया जा सकता है, और एस्ट्रोन androstenedione से। इसके अलावा, कई शरीर के ऊतकों में मौजूद एंजाइम स्टेरॉयड डिहाइड्रोजनेज की कार्रवाई के कारण एस्ट्राडियोल और एस्ट्रोन परस्पर परिवर्तनीय हैं। एस्ट्रिऑल को अंडाशय में संश्लेषित किया जाता है, और एस्ट्रोन और एस्ट्राडियोल के चयापचय के परिणामस्वरूप - यकृत और कुछ अन्य अंगों में।
स्टेरॉयड हार्मोन का जैवसंश्लेषण बहुत विशिष्ट एंजाइमी सिस्टम की कार्रवाई के तहत होता है। लेकिन चूंकि प्रोजेस्टेरोन, एण्ड्रोजन और एस्ट्रोजेन के गठन के लिए अलग-अलग रास्ते आपस में जुड़े हुए हैं और हार्मोन-उत्पादक ऊतकों की जैवसंश्लेषण क्षमताएं काफी हद तक मेल खाती हैं, एक या दूसरे हार्मोन का प्रमुख गठन एंजाइमों के स्थानीयकरण पर निर्भर करता है। तो, सभी सेक्स स्टेरॉयड के जैवसंश्लेषण में, एक महत्वपूर्ण भूमिका 3|3-ओल-स्टेरॉयड डिहाइड्रोजनेज की होती है, जो प्रेग्नेंसीलोन को प्रोजेस्टेरोन में परिवर्तित करती है। यह एंजाइम कई अंतःस्रावी अंगों में पाया जाता है, इसलिए स्टेरॉइडोजेनेसिस के पहले चरण अंडाशय और अधिवृक्क प्रांतस्था दोनों में हो सकते हैं। एंजाइमों के विभिन्न स्थानीयकरण के कारण एण्ड्रोजन, जेनेजेन और एस्ट्रोजेन के निर्माण में आगे के चरण, मुख्य रूप से एक या दूसरे अंतःस्रावी अंग में आगे बढ़ते हैं।
स्टेरॉयड हार्मोन के आदान-प्रदान और जैवसंश्लेषण के लिए एक सामान्य मार्ग का अस्तित्व इस तथ्य की भी व्याख्या करता है कि स्टेरॉयड का उत्पादन करने वाली प्रत्येक ग्रंथि में इस समूह के अन्य हार्मोन की थोड़ी मात्रा भी बनती है। तो, अंडाशय के अलावा, अधिवृक्क ग्रंथियों में एस्ट्रोजेन की थोड़ी मात्रा का उत्पादन होता है, प्रोजेस्टेरोन का निर्माण होता है, कॉर्पस ल्यूटियम के अलावा, कूप और अधिवृक्क ग्रंथियों में, और एण्ड्रोजन - अंडाशय और अधिवृक्क ग्रंथियों में।
अंतःस्रावी ग्रंथियों में स्टेरॉयड हार्मोन के चयापचय का उल्लंघन, जो अक्सर एंजाइमेटिक परिवर्तनों से जुड़ा होता है, उन पदार्थों के शरीर में संचय का कारण बन सकता है जो जैवसंश्लेषण के मध्यवर्ती उत्पाद हैं और आमतौर पर केवल थोड़ी मात्रा में मौजूद होते हैं। तो, एण्ड्रोजन को एस्ट्रोजेन (एरोमेटाइज़ेशन एंजाइम) में बदलने वाले एंजाइमों की अपर्याप्तता एक महिला के शरीर में एण्ड्रोजन में तेज वृद्धि और एक वायरल सिंड्रोम की घटना का कारण बन सकती है। एंजाइमों की कमी (D5,3 | 3-ओल-स्टेरॉयड डिहाइड्रोजनेज, जो प्रेग्नेंसीलोन को प्रोजेस्टेरोन में परिवर्तित करने के चरण में कार्य करता है, साथ ही एंड्रोस्टेनिओन और टेस्टोस्टेरोन के एस्ट्रोजेन के रूपांतरण में शामिल एंजाइमों को सुगंधित करना) एक संभावित कारण हो सकता है (ई. ए. बोगडानोवा) , 1969)।
तथ्य यह है कि एण्ड्रोजन उत्तरार्द्ध के जैवसंश्लेषण में एस्ट्रोजेन के अग्रदूत हैं, इसकी पुष्टि कई प्रयोगात्मक और नैदानिक आंकड़ों से होती है। कार्बन-लेबल वाले एंड्रोजेनिक हार्मोन के साथ प्लेसेंटा और अंडाशय के ऊतक वर्गों के ऊष्मायन के दौरान प्रयोगों में, एस्ट्रोन में androstenedione का रूपांतरण दिखाया गया था। क्लिनिक में, एण्ड्रोजन (टेस्टोस्टेरोन प्रोपियोनेट) की भारी खुराक के साथ स्तन कैंसर के उपचार में, एस्ट्रोजन उत्सर्जन में मामूली वृद्धि पाई गई।