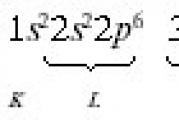Elektronų pasiskirstymo atome principai. Koks yra elektronų pasiskirstymas pagal energijos lygius skirtingiems cheminiams elementams Elektronų pasiskirstymas pagal energijos lygius lentelė
SUDĖTIS IR ELEKTRONIKA
ATOMO STRUKTŪRA
METODINIAI NURODYMAI IR KONTROLĖS UŽDUOTYS
Į MOKYMŲ PROGRAMĄ STUDENTIAMS
SPECIALIZUOTOS KLASĖS
BENDROSIOS UGDYMO MOKYKLOS
Tęsinys. Žiūrėkite pradžią № 4, 6/2005
Gairės
17. Atsižvelgdami į aprašytus modelius, apsvarstykite elektronų būseną ir pasiskirstymą energijos lygiuose ir kalio atomų orbitose ( Z= 19) ir skandis ( Z = 21).
Sprendimas
1) PSCE prieš kalį esantis elementas yra argonas ( Z= 18) turi tokį elektronų pasiskirstymą:
a) pagal atominius lygius:
b) pagal atomo orbitales:
Elektroninė argono atomo formulė:
![]()
Argono atomo elektroninė grafinė formulė:
Paskirstant elektronus K atome pagal Klečkovskio taisyklę, pirmenybė teikiama orbitalei 4 s(kvantinių skaičių suma n + l lygus: 4 + 0 = 4), palyginti su 3 orbita d(kvantinių skaičių suma n + l lygi: 3 + 2 = 5) kaip orbitalė, turinti mažiausią reikšmę n + l. Todėl kalio atomui elektronų pasiskirstymas per orbitas (elektronų grafinė formulė) turi tokią formą (žr. gairių 16 punktą):
Kalis priklauso s-elementai su tokia elektronine atomo formule (konfigūracija):
![]()
K atomo elektronų energijos lygio pasiskirstymas parodytas žemiau:

2) PSCE prieš skandį esantis elementas yra kalcis ( Z= 20) turi tokį elektronų pasiskirstymą:
a) pagal atominius lygius:

b) pagal atomo orbitales:
Elektroninė kalcio atomo formulė:

Iš 3 orbitų d (n + l lygus: 3 + 2 = 5) ir 4 p (n + l lygus: 4 + 1 = 5) paskirstant elektronus skandžio atome tarp orbitalių, pirmenybė turėtų būti teikiama 3 d-orbita kaip turinti mažiausią reikšmę n= 3 toms pačioms kvantinių skaičių sumoms ( n + l) lygus penkiems. Todėl skandis priklauso d-elementai, o jo atomas pasižymi tokiu elektronų pasiskirstymu tarp orbitų:
Elektroninė skandžio atomo formulė:

Sc atomo elektronų energijos lygio pasiskirstymas pavaizduotas žemiau:

18. Užbaikite piešinį, kad parodytumėte jo išvaizdą s-orbitalės ir trys R-orbitos, orientuotos išilgai ašių.

5 lentelė
Elektronų pasiskirstymas
pagal kvantinius lygius ir polygius
| Lukštas | Energija lygiu n |
Energija polygis l |
Magnetinis numerį m |
Skaičius orbitalės |
Riba numerį elektronų |
||||
|---|---|---|---|---|---|---|---|---|---|
| K | 1 | 0 (s) | 0 | 1 | 2 | ||||
| L | 2 | 0 (s) 1 (p) |
+1, 0, –1 |
|
|
||||
| M | 3 | 0 (s) 1 (p) 2(d) |
0
1, 0, –1 |
|
|
||||
| N | 4 | 0 (s) 1 (p) 2(d) 3(f) |
0 +1, 0, –1 +2, +1, 0, –1, –2 +3, +2, +1, 0, –1, –2, –3 |
|
|
20. Atomų energijos lygių užpildymo seką žr. lentelėje. 6.
21. Elementų skaičius D.I. Mendelejevo lentelės periode nustatomas pagal formules:
a) nelyginiams laikotarpiams:
Ln = (n + 1) 2 /2,
b) lygiems laikotarpiams:
Ln = (n + 2) 2 /2,
Kur Ln– elementų skaičius per laikotarpį, n– laikotarpio numeris.
Apibrėžkite elementų skaičius kiekviename D.I. Mendelejevo PSHE periode.
Paaiškinkite:
a) gautas skaitmeninis modelis elektronų būsenos atomuose ir jų pasiskirstymo tarp energijos lygių požiūriu;
b) elementų grupių skirstymas į pagrindinius ir antrinius pogrupius;
c) pagrindinių ir antrinių pogrupių skaičiaus nustatymas D. I. Mendelejevo PSHE atominės struktūros teorijos požiūriu.
Patikrinti ateityje Jūsų išvadas dėl 1 priedo (P-21).
22. Griežtas elementų išdėstymo periodiškumas D. I. Mendelejevo PSHE visiškai paaiškinamas nuosekliu atomų energijos lygių užpildymu (žr. 20 pastraipą aukščiau). Periodinio dėsnio, paremto elementų atomų elektroninės sandaros kitimo dėsningumais, pozicijos sutvirtėjimą, kurį pirmasis numatė N. Bohras, palengvino 72-ojo elemento atradimas. Chemikai ieškojo tuo metu neatrasto elemento tarp mineralų, kuriuose yra retųjų žemių elementų, remdamiesi klaidinga prielaida, kad 15 elementų turėtų būti klasifikuojami kaip lantanidai.
Analogiškai su pereinamaisiais elementais, lantanidų (elementų Nr. 58–71) skaičius turėtų būti lygus skirtumui tarp didžiausio elektronų skaičiaus viename N Ir M energijos lygiai
(32 – 18 = 14), t.y. lygus didžiausiam elektronų skaičiui per f-polygis (žr. 19 pastraipą aukščiau). Elementas su Z= 72 (hafnis Hf) yra cirkonio Zr analogas ir rastas cirkonio rūdose.
23. Kita svarbi lentelės analizės išvada. 6 20 punkte pateikta išvada apie atomų išorinių energijos lygių užpildymo elektronais periodiškumą, kuris lemia elementų ir jų junginių cheminių savybių kitimo periodiškumą.
6 lentelė
Elektroninės atomų konfigūracijos
pirmieji 20 periodinės lentelės elementų
| Atominis numerį |
Obozas- prasmė |
Sluoksnis | K | L | M | N |
| n | 1 | 2 | 3 | 4 | ||
| l | 0 | 0, 1 | 0, 1, 2 | 0, 1, 2, 3 | ||
| Polygis | 1s | 2s, 2p | 3s, 3p, 3d | 4s, 4p, 4d, 4f | ||
| Elektronų skaičius tam tikrame polygyje | ||||||
| 1 2 |
H Jis |
1 2 |
||||
| 3 4 5 6 7 8 9 10 |
Li Būk B C N O F Ne |
2 2 2 2 2 2 2 2 |
1, 0 2, 0 2, 1 2, 2 2, 3 2, 4 2, 5 2, 6 |
|||
| 11 12 13 14 15 16 17 18 |
Na Mg Al Si P S Cl Ar |
2 2 2 2 2 2 2 2 |
2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 2, 6 |
1, 0, 0 2, 0, 0 2, 1, 0 2, 2, 0 2, 3, 0 2, 4, 0 2, 5, 0 2, 6, 0 |
||
| 19 20 |
K Ca |
2 2 |
2, 6 2, 6 |
2, 6, 0 2, 6, 0 |
1, 0, 0, 0 2, 0, 0, 0 |
|
Taigi antrasis D.I. Mendelejevo lentelės periodas susideda iš aštuonių elementų su šiais polygiais:
|
Pereinant nuo ličio prie neono, atomo branduolio krūvis palaipsniui didėja nuo Z= nuo 3 iki Z= 10, o tai reiškia, kad didėja elektronų traukos į branduolį jėgos ir dėl to mažėja šių elementų atomų spinduliai. Todėl atomo gebėjimas paaukoti elektronus (paprastai metalo savybė), išreikštas ličio atome, palaipsniui silpnėja pereinant nuo ličio prie fluoro. Pastarasis yra tipiškas nemetalas, tai yra elementas, galintis labiau nei kiti įgyti elektronus.
Pradedant nuo elemento šalia neono (Na, Z= 11) atomų elektroninės struktūros kartojasi, todėl jų išorinių elektronų apvalkalų elektroninės konfigūracijos žymimos panašiai ( n– laikotarpio numeris):
ns 1 (Li, Na), ns 2 (Be, Mg), ns 2 n.p. 1 (B, Al), ns 2 n.p. 2 (C, Si) ir tt
Ketvirtajame D. I. Mendelejevo lentelės periode atsiranda pereinamieji elementai, priklausantys antriniams pogrupiams.
24. Tam pačiam pogrupiui priklausantys elementai turi panašų elektronų išsidėstymą atomų išoriniuose elektroniniuose lygiuose. Pavyzdžiui, visi halogeno atomai (pagrindinis VII grupės pogrupis) turi elektroninę konfigūraciją ns 2 n.p. 5, o tos pačios grupės šoninio pogrupio elementų atomai pasižymi elektronine konfigūracija ( n– 1)s 2 (n– 1)p 6 (n– 1)d 5 ns 2 .
Kokia yra elementų, priklausančių skirtingiems tos pačios D. I. Mendelejevo lentelės grupės pogrupiams, atomų panašumų ir skirtumų esmė? Ateityje savo išvadas patikrinkite 1 priede (P-24).
25. Skaitinė atomo valentingumo vertė, nustatoma pagal jo suformuotų kovalentinių cheminių jungčių skaičių, atspindi elemento padėtį D. I. Mendelejevo PSCE. Daugeliu atvejų elemento atomo valentingumas junginyje yra lygus grupės skaičiui D.I. Mendelejevo PSHE. Tačiau yra šios taisyklės išimčių. Pavyzdžiui, fosforo atomas išorinėje (trečias, M) energijos lygyje yra trys nesuporuoti elektronai (3 R-orbitalės) ir laisvosios valentinės ląstelės d- orbitos. Vadinasi, fosforo atomui būdingas vadinamasis sužadinimas elektronas, susijęs su elektronų poros suporavimu ir vieno iš susidariusių nesuporuotų elektronų perėjimu į 3 d-orbitinė. Sužadintoje fosforo atomo būsenoje gali susidaryti penki kovalentiniai ryšiai, o pagrindinėje būsenoje - tik trys.

Azoto atomui sužadinta būsena yra netipinė, nes šiame atome išoriniame energijos lygyje elektronų skaičius ir būsena yra tokie patys kaip ir fosforo atome, tačiau laisvų ląstelių nėra, o atomui trūksta tik trijų elektronų. šio lygio užbaigtumas ir stabilumas.
Kodėl tuomet didžiausias azoto atomo valentingumas junginiuose (t.y. gebėjimas sudaryti bendras elektronų poras) yra ne III, o IV?
26. Pastraipų kartojimas. 16, 17 metodologinio tobulinimo, galima paaiškinti energijos lygių užpildymo elektronais tvarką D.I. Mendelejevo PSHE 4-ojo didžiojo periodo elementų atomuose. Lyginė šio laikotarpio serija prasideda nuo pagrindinių pogrupių elementų - 39 K ir 40 Ca, kurie yra tipiški pastovaus valentingumo metalai, ir jau su elementu Nr. 21 ( Z= 21, Sc), tada yra šoninių pogrupių elementai, vadinami d- elementai arba pereinamieji. Pabandykite paaiškinti šių pavadinimų esmę ir pateikite atitinkamų pavyzdžių. Ateityje savo išvadų teisingumą patikrinkite pagal 1 priedą (P-26).
27.
Cheminis vandenilio H simbolis D.I. Mendelejevo PSHE taip pat įtrauktas į pagrindinį pogrupį
I grupę, o į pagrindinį VII grupės pogrupį. Kodėl tai priimtina? Ateityje patikrinkite 1 priede (P-27) pateiktų išvadų teisingumą.
Paskirstant elektronus tarp kvantinių ląstelių, vadovaujamasi šiomis gairėmis:
Remiantis Pauli principu: atomas negali turėti dviejų vienodų elektronų
visų kvantinių skaičių reikšmių rinkinys, ty atominėje orbitoje negali būti
spaudžia daugiau nei du elektronus, o jų sukimosi momentai turi būti priešingi
priešingas
↓
Žymėjimo sistema apskritai atrodo taip:
kur p yra pagrindinis, ℓ yra orbitinis kvantinis skaičius; x yra elektronų skaičius,
tam tikroje kvantinėje būsenoje. Pavyzdžiui, 4d3 įrašas gali būti
aiškinama taip: trys elektronai užima ketvirtąją energiją
Slidinėjimo lygis, d-sublygis.
Energetinių polygių išsivystymo pobūdis lemia priklausomybę
elementas į vieną ar kitą elektroninę šeimą.
S elementuose išorinis s polygis yra sudarytas, pavyzdžiui,
11 Na 1s2 2s2 2p6 3s1
P elementuose išorinis p polygis yra sudarytas, pavyzdžiui,
9 F 1s 2s2 2p5 .
S- ir p-šeimos apima pagrindinių periodinės lentelės pogrupių elementus.
tsy D.I. Mendelejevas.
D elementuose sudaromas priešpaskutinio lygio d polygis,
Pavyzdžiui,
2 2 6 2 6 2 2
22Ti 1s 2s 2p 3s 3p 3d 4s .
D-šeima apima šalutinių pogrupių elementus. Šio se-
šeimos yra paskutinio energijos lygio s-elektronai ir d-elektronai
priešpaskutinis lygis.
F elementuose yra sukurtas trečiojo išorinio lygio f polygis,
Pavyzdžiui,
58Се 1s22s22p63s23p63d l04s24p64d l04f l5s25p65d16s2.
F-elektronų šeimos atstovai yra lantanidai ir aktinidai.
Kvantinis skaičius gali turėti dvi reikšmes: Todėl atome gali būti ne daugiau kaip elektronai, esant tam tikros vertės būsenoms:

Juostos teorijos pagrindai
Remiantis Bohro postulatais, izoliuotame atome elektrono energija gali turėti griežtai atskiras reikšmes (taip pat sakoma, kad elektronas yra vienoje iš orbitų).
Esant keletui atomų, sujungtų cheminiu ryšiu (pavyzdžiui, molekulėje), elektronų orbitalės suskaidomos proporcingu atomų skaičiui ir susidaro vadinamosios molekulinės orbitalės. Toliau didėjant sistemai iki makroskopinio kristalo (atomų skaičius didesnis nei 10 20), orbitų skaičius tampa labai didelis, o kaimyninėse orbitose esančių elektronų energijų skirtumas atitinkamai yra labai mažas, energija lygiai yra suskirstyti į beveik ištisinius atskirus rinkinius – energijos zonas. Aukščiausia iš leistinų puslaidininkių ir dielektrikų energijos juostų, kuriose 0 K temperatūroje visas energijos būsenas užima elektronai, vadinama valentine juosta, kita – laidumo juosta. Metaluose laidumo juosta yra didžiausia leistina juosta, kurioje elektronai yra 0 K temperatūroje.
Juostos teorija remiasi šiais pagrindiniais aproksimacija:
1. Kieta medžiaga yra idealiai periodiškas kristalas.
2. Kristalinės gardelės mazgų pusiausvyros padėtys yra fiksuotos, tai yra, atomų branduoliai laikomi nejudančiais (adiabatinė aproksimacija). Mažos atomų vibracijos aplink pusiausvyros padėtį, kurias galima apibūdinti kaip fononus, vėliau įvedamos kaip elektroninės energijos spektro sutrikimas.
3. Daugelio elektronų problema redukuojama iki vieno elektrono: visų kitų įtaką tam tikram elektronui apibūdina koks nors vidutinis periodinis laukas.
Kai kurie iš esmės daugiaelektroniniai reiškiniai, tokie kaip feromagnetizmas, superlaidumas ir tie, kuriuose vaidina eksitonai, negali būti nuosekliai nagrinėjami juostos teorijos rėmuose. Tuo pačiu metu, taikant bendresnį požiūrį į kietųjų kūnų teorijos konstravimą, paaiškėjo, kad daugelis juostos teorijos rezultatų yra platesni nei pradinės prielaidos.
Fotolaidumas.
Fotolaidumas- medžiagos elektrinio laidumo pasikeitimo reiškinys, kai sugeria elektromagnetinę spinduliuotę, tokią kaip matoma, infraraudonoji, ultravioletinė ar rentgeno spinduliuotė.
Puslaidininkiams būdingas fotolaidumas. Puslaidininkių elektrinį laidumą riboja krūvininkų trūkumas. Kai fotonas absorbuojamas, elektronas juda iš valentinės juostos į laidumo juostą. Dėl to susidaro krūvininkų pora: elektronas laidumo juostoje ir skylė valentinėje juostoje. Abu krūvininkai, kai į puslaidininkį įjungiama įtampa, sukuria elektros srovę.
Kai vidiniame puslaidininkyje sužadinamas fotolaidumas, fotono energija turi viršyti juostos tarpą. Legiruotame puslaidininkyje fotono sugertį gali lydėti perėjimas nuo juostos tarpoje esančio lygio, o tai leidžia padidinti šviesos bangos ilgį, sukeliantį fotolaidumą. Ši aplinkybė svarbi norint aptikti infraraudonąją spinduliuotę. Aukšto fotolaidumo sąlyga taip pat yra didelis šviesos sugerties greitis, kuris realizuojamas tiesioginio tarpo puslaidininkiuose
Kvantiniai reiškiniai
37) Branduolinė struktūra ir radioaktyvumas
Atomo branduolys- centrinė atomo dalis, kurioje sutelkta didžioji jo masės dalis (daugiau nei 99,9%). Branduolys yra teigiamai įkrautas, branduolio krūvį lemia cheminis elementas, kuriam priklauso atomas. Įvairių atomų branduolių dydžiai yra keli femtometrai, kurie yra daugiau nei 10 tūkstančių kartų mažesni už paties atomo dydį.
Protonų skaičius branduolyje vadinamas jo krūvio skaičiumi - šis skaičius yra lygus elemento, kuriam priklauso atomas, eilės numeriui Mendelejevo lentelėje (Periodinėje elementų lentelėje). Protonų skaičius branduolyje lemia neutralaus atomo elektronų apvalkalo struktūrą, taigi ir atitinkamo elemento chemines savybes. Neutronų skaičius branduolyje vadinamas jo izotopinis skaičius. Branduoliai, turintys vienodą protonų skaičių ir skirtingą neutronų skaičių, vadinami izotopais. Branduoliai, turintys tą patį neutronų skaičių, bet skirtingą protonų skaičių, vadinami izotonais. Terminai izotopas ir izotonas taip pat vartojami nurodant atomus, kuriuose yra šių branduolių, taip pat apibūdinant nechemines vieno cheminio elemento atmainas. Bendras nukleonų skaičius branduolyje vadinamas jo masės skaičiumi () ir yra maždaug lygus vidutinei atomo masei, parodytai periodinėje lentelėje. Nuklidai, turintys tą patį masės skaičių, bet skirtingą protonų ir neutronų sudėtį, paprastai vadinami izobarais.
Radioaktyvusis skilimas(iš lat. spindulys"spindulys" ir āctīvus„efektyvus“ - spontaniškas sudėties pokytis (mokestis Z, masės skaičius A) arba nestabilių atomų branduolių vidinė struktūra, išspinduliuojant elementariąsias daleles, gama spindulius ir (arba) branduolio fragmentus. Taip pat vadinamas radioaktyvaus skilimo procesas radioaktyvumas, o atitinkami branduoliai (nuklidai, izotopai ir cheminiai elementai) yra radioaktyvūs. Medžiagos, kuriose yra radioaktyvių branduolių, dar vadinamos radioaktyviosiomis.
Pirmas būdas: Elektronai gali būti lengvai paskirstomi po lygius pagal tam tikras taisykles. Pirma, jums reikia spalvų lentelės. Įsivaizduokime kiekvieną elementą kaip vieną naują elektroną.Kiekvienas periodas yra atitinkamas lygis, s.p-elektronai visada yra savo periode, d-elektronai yra vienu lygiu žemiau (3 d-elektronai yra toli 4-ame periode), f-elektronai yra 2 lygiais žemesnis. Tiesiog paimame lentelę ir skaitome pagal elemento spalvą, s, p elementams lygio numeris atitinka periodo numerį, jei pasiekiame d elementą, lygiu rašome vienu mažiau nei periodo skaičius kurioje yra šis elementas (jei elementas yra 4-ajame periode, vadinasi, 3 d). Tą patį darome ir su f elementu, tik lygį, mažesnį už periodo numerį, nurodome 2 reikšmėmis (jei elementas yra 6-ame periode, vadinasi, 4 f).
Antras būdas: Būtina visus polygius rodyti vieno langelio pavidalu, o lygiai turi būti išdėstyti vienas po kito simetriškai, polygis po žemesniu lygiu. Kiekvienoje ląstelėje parašykite maksimalų tam tikro polygio elektronų skaičių. Ir paskutinis veiksmas yra įstrižai (nuo viršutinio kampo iki apačios) surišti sub-lygius su rodykle. Skaitykite polygius iš viršaus į apačią link rodyklės galo iki norimo atomo elektronų skaičiaus.
Parsisiųsti:
Peržiūra:
Meistriškumo klasė šia tema:"Atomų energijos lygių užpildymo elektronais tvarka."
Pamokos tikslas: Apsvarstykite galimybes greičiau parašyti trumpą elektroninę atomo konfigūraciją.
Priklausomai nuo to, kuris polygis atome užpildytas paskutinis, visi cheminiai elementai skirstomi į 4 elektronų šeimas: s-, p-, d-, f-elementus. Elementai, kurių atomai paskutiniai užpildo išorinio lygio s polygį, vadinami s elementais. S-elementams valentinių elektronų yra išorinio energijos lygio s-elektronai. P elementams išorinio lygio p polygis užpildomas paskutinis. Jų valentiniai elektronai yra išorinio lygio p ir s polygiuose. D-elementams priešišorinio energijos lygio d-polygis užpildomas paskutinis, o valentiniai elektronai yra išorinio s-elektronai ir priešišorinio energijos lygio d-elektronai. F elementų atveju paskutinis užpildomas yra trečiojo išorinio energijos lygio f polygis.
Elektroninė atomo konfigūracija taip pat gali būti pavaizduota elektronų išdėstymo kvantinėse ląstelėse diagramose, kurios yra grafinis atominės orbitos vaizdas. Kiekvienoje kvantinėje ląstelėje gali būti ne daugiau kaip du elektronai su priešingos krypties sukiniais ↓. Elektronų išdėstymo tvarka viename polygyje nustatoma pagal taisyklę Hunda: Polygyje elektronai dedami taip, kad jų bendras sukinys būtų maksimalus. Kitaip tariant, tam tikro polygio orbitales pirmiausia užpildo vienas elektronas, turintis tuos pačius sukinius, o paskui antras elektronas su priešingais sukiniais.
Elektroninei atomo konfigūracijai įrašyti gali būti naudojami keli metodai.
Pirmas būdas:
Pasirinktam elementui pagal jo vietą D.I.Mendelejevo periodinėje cheminių elementų lentelėje galima užrašyti tam tikrą laikotarpį atitinkančią atomo elektroninio apvalkalo struktūros matricą.
Pavyzdžiui, jodo elementas: 127 53 I 1s2s2p3s3p3d4s4p4d4f5s5p5d5f
Naudodami lentelę, nuosekliai judėdami nuo elemento prie elemento, galite užpildyti matricą pagal elemento serijos numerį ir polygių užpildymo tvarką:
127 53 I 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 0 5s 2 5p 5 5d 0 5f 0
Tačiau polygiai užpildomi seka s-f-d-p, ir naudojant šį metodą mes nepastebime jokios elektronų apvalkalų užpildymo tvarkos.
Antras būdas:
Galite apsvarstyti lygių ir polygių užpildymo elektronais tvarką, naudodami pagrindinio principo sąvokas - mažiausio energijos kiekio principą: stabiliausia atomo būsena yra ta, kurioje jo elektronai turi mažiausią energiją.
Tie. remiantisPauli's Ban, Hundo ir Kleczkowski's Rules
Paulio pašalinimas : atomas negali turėti dviejų elektronų, kurių keturi kvantiniai skaičiai būtų vienodi (tai yra, kiekviena atominė orbita negali būti užpildyta daugiau nei dviem elektronais ir antilygiagrečiais sukiniais.)
Hundo taisyklė : elektronai išsidėstę identiškose orbitalėse taip, kad jų bendras sukinių skaičius būtų maksimalus, t.y. Stabiliausia atomo būsena atitinka didžiausią galimą nesuporuotų elektronų, turinčių vienodus sukinius, skaičių.
Klečkovskio taisyklės: A) Elektroninių sluoksnių užpildymas elektronais prasideda lygiais ir polygiais, kurių n ir l reikšmės yra mažiausios, ir vyksta didėjančia tvarka n+l;
B) Jei dviejų orbitalių suma n+l yra vienoda, tai orbitalė, kurios n reikšmė mažesnė, pirmiausia užpildoma elektronais.
Pirmuoju atveju neparodoma polygių pildymo seka, o antruoju atveju reikia laiko sudaryti lentelę.
Lentelė Nr.2
Tvarka, kuria elektronai užpildo atomų energijos lygius.
Kvantiniai skaičiai | Kvantinių skaičių suma n+l | Užpildoma orbita |
|
Paskirstant elektronus atome KAM pagal Klečkovskio taisyklę pirmenybė teikiama 4s orbitalei
Todėl atomui kalio elektronų pasiskirstymas per orbitas (elektronų grafinė formulė) turi formą
Skandis priklauso d elementams, o jo atomui būdingas toks elektronų pasiskirstymas tarp orbitų:
Remdamiesi Klečkovskio taisykle, matome nuoseklaus polygių užpildymo tvarką. Pirmuoju atveju neparodoma polygių pildymo seka, o antruoju atveju reikia laiko sudaryti lentelę. Todėl siūlau jums priimtinesnes nuoseklaus orbitalių užpildymo galimybes.
Pirmas būdas : Elektronai gali būti lengvai paskirstomi po lygius pagal tam tikras taisykles. Pirma, jums reikia spalvų lentelės. Įsivaizduokime kiekvieną elementą kaip vieną naują elektroną.Kiekvienas periodas yra atitinkamas lygis, s.p-elektronai visada yra savo periode, d-elektronai yra vienu lygiu žemiau (3 d-elektronai yra toli 4-ame periode), f-elektronai yra 2 lygiais žemesnis. Tiesiog paimame lentelę ir skaitome pagal elemento spalvą, s, p elementams lygio numeris atitinka periodo numerį, jei pasiekiame d elementą, lygiu rašome vienu mažiau nei periodo skaičius kurioje yra šis elementas (jei elementas yra 4-ajame periode, vadinasi, 3 d). Tą patį darome ir su f elementu, tik lygį, mažesnį už periodo numerį, nurodome 2 reikšmėmis (jei elementas yra 6-ame periode, vadinasi, 4 f).
Antras būdas : Būtina visus polygius rodyti vieno langelio pavidalu, o lygiai turi būti išdėstyti vienas po kito simetriškai, polygis po žemesniu lygiu. Kiekvienoje ląstelėje parašykite maksimalų tam tikro polygio elektronų skaičių. Ir paskutinis veiksmas yra įstrižai (nuo viršutinio kampo iki apačios) surišti sub-lygius su rodykle. Skaitykite polygius iš viršaus į apačią link rodyklės galo iki norimo atomo elektronų skaičiaus.
Elektronų pasiskirstymas atome vykdomas pagal 3 kvantinės mechanikos nuostatas: Pauli principą; minimalios energijos principas; Hundo taisyklė.
Pagal Pauli principą Atomas negali turėti dviejų elektronų, kurių visų keturių kvantinių skaičių reikšmės būtų vienodos. Pauli principas nustato maksimalų elektronų skaičių vienoje orbitoje, lygyje ir polygyje. Kadangi AO charakterizuojamas trimis kvantiniais skaičiais n, l, ml, tam tikros orbitos elektronai gali skirtis tik savo sukimosi kvantiniu skaičiumi ms. Bet ms gali turėti tik dvi reikšmes +½ ir -½.
Vadinasi, vienoje orbitoje gali būti ne daugiau kaip du elektronai su priešingais sukiniais. Didžiausias elektronų skaičius energijos lygyje apibrėžiamas kaip 2 n 2, o žemesniame lygyje - kaip 2 (2 l+1). Didžiausias elektronų, esančių skirtinguose lygiuose ir polygiuose, skaičius pateiktas lentelėje. 2.1.
Didžiausias elektronų skaičius kvantiniuose ir sublygiuose
| Energijos lygis | Energijos polygis | Galimos magnetinio kvantinio skaičiaus reikšmės ml | Akcinių bendrovių skaičius | Didžiausias elektronų skaičius vienam | ||
| polygis | lygiu | polygis | lygiu | |||
| K (n= 1) | s (l= 0) | |||||
| L (n= 2) | s (l= 0) p (l= 1) | -1, 0, 1 | ||||
| M (n= 3) | s (l= 0) p (l= 1) d (l= 2) | -1, 0, 1 -2, -1, 0, 1, 2 | ||||
| N (n= 4) | s (l= 0) p (l= 1) d (l= 2) f (l= 3) | -1, 0, 1 -2, -1, 0, 1, 2 -3, -2, -1, 0, 1, 2, 3 |
Orbitalių užpildymo elektronais seka atliekama pagal minimalios energijos principas, Kuriuo elektronai užpildo orbitales pagal didėjantį orbitų energijos lygį. Nustatoma orbitalių eiliškumas energijoje Klečkovskio taisyklė : energijos padidėjimas ir atitinkamai orbitalių užpildymas vyksta didėjančia suma (n + l), o su lygia suma (n + l) - didėjančia n tvarka.
Elektronų pasiskirstymo tarp energijos lygių ir polygių tvarka atomo apvalkale tai vadinama elektroninė konfigūracija. Rašant elektroninę konfigūraciją, lygio numeris (pagrindinis kvantinis skaičius) žymimas skaičiais 1, 2, 3, 4..., polygis (orbitinis kvantinis skaičius) - raidėmis. s, p, d, f. Elektronų skaičius polygyje nurodomas skaičiumi, kuris užrašomas polygio simbolio viršuje. Pavyzdžiui, sieros atomo elektroninė konfigūracija yra 16 S 1 s 2 2s 2 2p 6 3s 2 3p 4 ir vanadis 23 V 1 s 2 2s 2 2p 6 3s 2 3p 6 3d°/i> 3 4 s 2 .
Atomų chemines savybes daugiausia lemia išorinių energijos lygių struktūra, kuri vadinama valentingumas. Visiškai užbaigti energijos lygiai nedalyvauja cheminėje sąveikoje. Todėl, siekiant trumpumo registruojant elektroninę atomo konfigūraciją, jie dažnai žymimi ankstesnių tauriųjų dujų simboliu. Taigi, siera: 3 s 2 3p 4 ; vanadžiui: 3 d 3 4s 2. Tuo pačiu sutrumpintas žymėjimas aiškiai išryškina valentinius elektronus, lemiančius chemines elemento atomų savybes.
Priklausomai nuo to, kuris atomo polygis užpildytas paskutinis, visi cheminiai elementai skirstomi į 4 elektronines šeimas: s-, p-, d-, f- elementai. Elementai, kurių atomai paskutiniai užpildo išorinio lygio s polygį, vadinami s elementais. U s- valentiniai elementai yra s-išorinio energijos lygio elektronai.
U p-elementai, išorinio lygio p polygis užpildomas paskutinis. Jų valentiniai elektronai yra ant p- Ir s- išorinio sluoksnio posluoksniai. U d-elementai, priešišorinio lygio d-polygis užpildomas paskutinis ir valentingumas yra s- elektronai išorinės ir d- išankstinių išorinių energijos lygių elektronai. U f-elementai, paskutinis turi būti užpildytas trečiojo išorinio energijos lygio f polygis.
Elektroninė atomo konfigūracija taip pat gali būti pavaizduota elektronų išdėstymo kvantinėse ląstelėse diagramose, kurios yra grafinis atominės orbitos vaizdas. Kiekvienoje kvantinėje ląstelėje gali būti ne daugiau kaip du elektronai su priešingais sukiniais. Elektronų išdėstymo viename polygyje tvarka nustatoma pagal Hundo taisyklę: Polygyje elektronai dedami taip, kad jų bendras sukinys būtų maksimalus. Kitaip tariant, tam tikro polygio orbitales pirmiausia užpildo vienas elektronas, turintis tuos pačius sukinius, o paskui antras elektronas su priešingais sukiniais.
Visas sukimasis R- sieros atomo S trečiojo energijos lygio elektronai ms= ½ - ½ + ½ + ½ = 1; d- vanadžio atomo elektronai,
S ms= ½ + ½ + ½ = 3/2.
Dažnai grafiškai pavaizduojama ne visa elektroninė formulė, o tik tie polygiai, kuriuose yra valentiniai elektronai, pvz.
16 S…3 s 2 3p 4 ; 23 V…3 d 3 4s 2 .
Grafiškai vaizduojant elektroninę atomo konfigūraciją sužadintoje būsenoje, laisvos valentinės orbitalės vaizduojamos kartu su užpildytomis. Pavyzdžiui, fosforo atome trečiajame energijos lygyje yra vienas s-AO, trys R-AO ir penki d-AO. Fosforo atomo elektroninė konfigūracija pagrindinėje būsenoje turi formą
15 R... 3 s 2 3p 3 .
Fosforo valentingumas, nustatomas pagal nesuporuotų elektronų skaičių, lygus 3. Kai atomas pereina į sužadintą būseną, 3 būsenos elektronai susiporuoja s o vienas iš elektronų su s- gali eiti į žemesnį lygį d- žemesnio lygio:
P*… 3 s 2 3p 3 3d 1
Šiuo atveju fosforo valentingumas pasikeičia nuo trijų (PCl 3) pagrindinėje būsenoje iki penkių (PCl 5) sužadintoje būsenoje.
Jei identiškos dalelės turi tuos pačius kvantinius skaičius, tai jų banginė funkcija yra simetriška dalelių permutacijos atžvilgiu. Iš to išplaukia, kad du identiški fermionai, įtraukti į tą pačią sistemą, negali būti tose pačiose būsenose, nes fermionams bangos funkcija turi būti antisimetriška. Apibendrindamas eksperimentinius duomenis, W. Pauli suformavo principu išimtis , Kuriuo fermionų sistemų pasitaiko gamtoje tik valstijose,apibūdinamas antisimetrinėmis bangų funkcijomis(kvantinė mechaninė Pauli principo formuluotė).
Iš šios pozicijos seka paprastesnė Pauli principo formuluotė, kurią jis įtraukė į kvantinę teoriją (1925) dar prieš kvantinės mechanikos konstravimą: identiškų fermionų sistemoje bet kurios iš jų negali vienu metu būti toje pačioje būsenoje . Atkreipkite dėmesį, kad identiškų tos pačios būsenos bozonų skaičius neribojamas.
Prisiminkime, kad elektrono būseną atome vienareikšmiškai lemia aibė keturi kvantiniai skaičiai :
· pagrindinis n ;
· orbitinė l ![]() , paprastai šios būsenos žymimos 1 s, 2d, 3f;
, paprastai šios būsenos žymimos 1 s, 2d, 3f;
magnetinis ();
· magnetinis sukimasis ().
Elektronų pasiskirstymas atome vyksta pagal Pauli principą, kuris gali būti suformuluotas atomui paprasčiausia forma: tas pats atomas negali turėti daugiau nei vieno elektrono su tuo pačiu keturių kvantinių skaičių rinkiniu: n, l, , :
Z (n, l, , ) = 0 arba 1,
Kur Z (n, l, , ) – elektronų skaičius kvantinėje būsenoje, apibūdinamas keturių kvantinių skaičių rinkiniu: n, l... Taigi Pauli principas teigia kad du elektronai ,surišti tame pačiame atome skiriasi reikšme ,bent jau ,vienas kvantinis skaičius .
Didžiausias elektronų skaičius būsenose, aprašytose trijų kvantinių skaičių rinkiniu n, l Ir m, ir skiriasi tik elektronų sukinių orientacija yra lygus:
| , | (8.2.1) |
nes sukimosi kvantinis skaičius gali turėti tik dvi reikšmes: 1/2 ir –1/2.
Didžiausias elektronų skaičius būsenose, apibrėžtose dviem kvantiniais skaičiais n Ir l:
| (8.2.2) |
Šiuo atveju elektrono orbitinio kampinio impulso vektorius gali užimti erdvę (2 l+ 1) skirtingos orientacijos (8.1 pav.).

Didžiausias elektronų skaičius būsenose, nustatomas pagal pagrindinio kvantinio skaičiaus reikšmę n, lygus:
| (8.2.3) |
Elektronų rinkimas kelių elektronų atome,turintys tą patį pagrindinį kvantinį skaičių n,paskambino elektronų apvalkalas arba sluoksnis .
Kiekviename apvalkale elektronai pasiskirstę pagal sublukštai , atitinkantis tai l.
Erdvės regionas,kurioje yra didelė tikimybė aptikti elektroną, paskambino subshell arba orbita . Pagrindiniai orbitų tipai parodyti fig. 8.1.
Kadangi orbitinis kvantinis skaičius įgauna reikšmes nuo 0 iki , posluoksnių skaičius yra lygus eilės skaičiui n kriauklės. Elektronų skaičius subapvale nustatomas pagal magnetinio ir magnetinio sukinio kvantinius skaičius: maksimalų elektronų skaičių subapvale su tam tikru l lygus 2(2 l+ 1). Apvalkalų žymėjimai, taip pat elektronų pasiskirstymas tarp apvalkalų ir posluoksnių pateikti lentelėje. 1.
1 lentelė
| Pagrindinis kvantinis skaičius n |
|||||||||||||||
| Korpuso simbolis |
|||||||||||||||
| Maksimalus elektronų skaičius apvalkale |
|||||||||||||||
| Orbitinis kvantinis skaičius l |
|||||||||||||||
| Subshell simbolis |
|||||||||||||||
| Didžiausias skaičius elektronų viduje subshell |
|||||||||||||||